Новости
Цель - проанализировать изменения артериального давления (АД) до и после тренировки во взаимосвязи с показателями ультразвукового исследования сердца и сосудов шеи у спортсменов-ветеранов.
Материал и методы. Проводилось анкетирование 200 конкурентоспособных спортсменов в возрасте от 40 до 72 лет для выявления основных факторов сердечно-сосудистого риска, измерялось АД в положении стоя в покое (до начала разминки) и непосредственно после спортивной нагрузки, выполнялось ультразвуковое исследование сердца и сосудов шеи. Учитывался установленный ранее врачом диагноз "артериальная гипертензия" (АГ).
Результаты. У 48% из всех обследованных регистрировалось систолическое артериальное давление (САД) выше 139 мм рт.ст. и у 42% - диастолическое (ДАД) выше 89 мм рт.ст. до начала разминки. После тренировочной нагрузки повышенное САД отмечалось у 39%, а повышенное ДАД - у 36% спортсменов-ветеранов.
По данным ультразвукового исследования, в среднем размеры камер сердца и диаметр сосудов шеи находились в пределах нормы. Гипертрофия миокарда левого желудочка (ЛЖ) встречалась у 48%, а диастолическая дисфункция - у 61%. Эти отклонения были в начальных стадиях практически у всех обследуемых. Большинство пациентов с гипертрофией ЛЖ и диастолической дисфункцией имели диагноз АГ (81 и 92%). У 80% комплекс интима-медиа (КИМ) был в пределах нормы.
Повышенные значения ДАД после тренировки ассоциировались с большей встречаемостью диастолической дисфункции, гипертрофии миокарда ЛЖ, относительно повышенными индексом массы миокарда ЛЖ, размерами предсердий и КИМ слева.
Заключение. Практически половина спортсменов среднего и пожилого возраста имеют диагноз "артериальная гипертензия", у трети обследованных без зарегистрированной АГ отмечается повышение АД >139/89 мм рт.ст. как до, так и после физической нагрузки. Повышение именно ДАД в ранний восстановительный период в большей мере, чем САД, ассоциируется с маркерами кардиоваскулярного риска: наличием гипертрофии левого желудочка, диастолической дисфункции и увеличением КИМ.
Ключевые слова:артериальная гипертензия, спортсмены-ветераны, кардиоваскулярный риск, физическая нагрузка
Для цитирования: Царева М.О., Шмойлова А.С., Шварц Ю.Г. Артериальная гипертензия и показатели ультразвукового исследования сердечно-сосудистой системы у спортсменов-ветеранов // Кардиология: новости мнения, обучение. 2019. Т. 7, № 1. С. 24-30. doi: 10.24411/2309-1908-2019-11003.
Одним из эффективных средств снижения кардиоваскулярного риска, в соответствии с современными руководствами, является регулярная физическая активность [1-3]. Дозированные физические упражнения ассоциируются со снижением вероятности фатальных и нефатальных коронарных событий, инсультов, а также общей смертности у лиц среднего и пожилого возраста.
Зависимость между пользой от физических нагрузок и их объемом в настоящее время активно исследуется, по некоторым данным, оно имеет нелинейный характер [4-7]. Продемонстрировано, что тренировка высокой интенсивности может быть связана с повышенным риском развития сердечной аритмии и даже первичной остановки сердца, особенно у предрасположенных лиц, уже имеющих заболевания сердечно-сосудистой системы. В отдельных работах установлено, что занятия спортом для достижения результатов являются фактором высокого кардиоваскулярного риска [8]. У ветеранов спорта, связанного с весьма высокими соревновательными нагрузками, велика вероятность развития миокардиального фиброза и ремоделирования сердца, причем предикторами последнего является высокое артериальное давление (АД) в момент нагрузки [9]. Особого внимания в этом плане заслуживают спортсмены-ветераны старше 40 лет, участвующие в командных или в индивидуальных видах спорта, требующих систематической подготовки и регулярного участия в крупных соревнованиях. Если ориентироваться на сведения с многочисленных сайтов ветеранского спорта и данные литературы, число таких спортсменов быстро растет [10]. Очевидно, в России счет идет на десятки, если не сотни тысяч. Как показали наши предыдущие исследования, практически половина спортсменов среднего и пожилого возраста имеют диагноз "артериальная гипертензия", из них менее половины получают регулярную антигипертензивную терапию.
У значительной части спортсменов-ветеранов отмечается повышение АД как до, так и после физической нагрузки, при этом треть спортсменов, не регистрирующих в повседневной жизни повышенные значения АД, имеют во время тренировки и соревнований систолическое АД (САД) выше 139 мм рт.ст., а около половины - повышение диастолического АД (ДАД) более 89 мм рт.ст. [11].
В крупных проспективных исследованиях лица, участвующие в соревнованиях и занимающиеся для достижения высокого результата, специально не выделялись. В этой связи заключения о том, что высокая физическая активность полезнее, чем умеренная, могут не касаться этих спортсменов.
Интенсивные физические нагрузки и эмоциональный стресс, которые неизбежны в спорте для достижения результатов, могут сопровождаться резким повышением артериального давления, увеличивать риск разрывов атеросклеротических бляшек и приводить к транзитор-ной активации системы свертывания крови и тромбообразованию [12], при этом длительно существующая неконтролируемая артериальная гипертензия под влиянием экстремальных физических нагрузок может усиливать уже существующую у спортсменов желудочковую дисфункцию [12].
Следует отметить, что четких границ для АД, измеряемого в таких условиях, не установлено. Именно поэтому трактовка такого рода стрессорного повышения АД пока затруднительна. Очевидно, частичное разрешение этой проблемы возможно при сопоставлении изменений АД во время спортивных занятий и морфофункционального состояния сердечно-сосудистой системы с использованием ультразвуковых методов. В этой связи следует отметить, что исследований с применением допплеровской эхокардиографии (ЭхоКГ) у немолодых соревнующихся спортсменов крайне мало, а работ, касающихся в этом плане артериальной гипертензии, практически нет.
Цель исследования - проанализировать изменения артериального давления до и после тренировки во взаимосвязи с показателями ультразвукового исследования сердца и сосудов шеи у спортсменов-ветеранов.
Материал и методы
В исследовании принимали участие 200 конкурентоспособных спортсменов в возрасте от 40 до 72 лет. Выбраны мало исследованные виды ветеранского спорта, в отличие от бега, относящиеся к группе весьма популярных и массовых в России: волейбол, хоккей и фехтование. Среди участников исследования насчитывались 151 мужчина и 49 женщин, средний возраст составил 52,9 лет. Общий спортивный стаж исследуемых - не менее 15 лет, в том числе не менее 3 лет занятий в последние годы. Все обследованные начинали спортивную карьеру в детстве, после чего следовал длительный перерыв с нерегулярными занятиями физической культурой. К критериям включения относилось и регулярное участие в соревнованиях областного, всероссийского или международного уровня.
Проводилось анкетирование для выявления основных факторов сердечно-сосудистого риска при помощи модифицированного нами опросника Говарда [13]. В данной работе учитывался установленный врачом диагноз "артериальная гипертензия" на основании зафиксированного ранее офисного АД ≥140 и 90 мм рт.ст. Лица, у которых такого диагноза не было, неоднократно измеряли в повседневной жизни свое домашнее АД и, в соответствии с общепринятыми критериями, не отмечали повышения домашнего АД ≥135 и 85 мм рт.ст. [14].
Проводилось измерение АД в положении стоя в покое (до начала разминки). Также стоя однократно измерялось АД после спортивной нагрузки: в течение 3-5 мин после 5-6 боев для фехтовальщиков, 2-3 игр для волейболистов и после одной игры у хоккеистов. По сути, измерение проводилось в период раннего восстановления.
Измерение АД проводилось в соответствии с рекомендациями [15] в положении стоя с использованием автоматического тонометра "Nissei WS-1011" осциллометрическим методом с местом наложения манжеты на запястье. Выбор данного тонометра обусловлен невозможностью использования классической манжеты в связи с наличием спортивной экипировки. Пределы допускаемой абсолютной погрешности для данного прибора при измерении давления воздуха в компрессионной манжете составили ±3 мм рт.ст.
Границами нормы считались значения АД 139 и 89 мм рт. ст., так как четких границ для АД, измеряемого в таких условиях, не установлено. Фиксировались случаи превышения нормы до и после нагрузки как для САД, так и для ДАД.
Ультразвуковое исследование выполнено у 46 случайно отобранных из общего числа спортсменов-ветеранов, сопоставимых по всем основным параметрам с общей группой.
Трансторокальная эхокардиография выполнялась на аппарате "Vivid 3 Pro vingmed technology" (General electric, США) в 1- и 2-мерном режимах с применением непрерывно- и импульсно-волнового допплера, цветного допплеровского картирования. Оценивали параметры полостей сердца. Учитывалось наличие гипертрофии миокарда и диастолической дисфункции как признаков поражения органов-мишеней, с применением общепринятых критериев [толщина миокарда левого желудочка ≥12 мм, величина конечно-диастолического размера (КДР) ≥64 мм] [16]. При проведении дуплексного сканирования сосудов брахиоцефального ствола оценивались диаметр артерий, скорость линейного кровотока (ЛСК), толщину комплекса интима-медиа (КИМ) общей сонной артерии (ОСА) и области бифуркации ОСА. Измерения осуществляли по стандартному протоколу на 3 уровнях сосудистого русла и билатерально в дистальной, медиальной и проксимальной точках задней стенки дистального сантиметра ОСА в конце диастолы [17, 18]. Границу величины КИМ оценивали между линиями, соответствующими внутреннему краю tunica adventicia и краю tunica intima, граничащему с просветом сосуда, по методике P. Pignoli и соавт. [19]. Использовали звуковую систему "Vivid 3 Pro", высокочастотный датчик 10 МГц.
Статистическую обработку полученных данных проводили с помощью программы Statistica 8.0 с использованием параметрических и непараметрических методов. В качестве характеристик групп использовались средние величины, стандартные отклонения. Динамику показателей оценивали с помощью критерия Краскела-Уоллиса, сравнения встречаемости признаков - %2, Йетса и Фишера.
Предполагалось, что превышение границ используемой в исследовании нормы АД при занятиях спортом можно оценить как негативный признак, а АД ≥140/90 мм рт.ст. как повышенное, в случае если это явление ассоциируется с неблагоприятными клиническими и инструментальными показателями, т.е. с признаками поражения органов-мишеней.
Результаты
По результатам проведенного анкетирования 54% опрошенных был выставлен диагноз "артериальная гипертензия". 20% курили ранее и 20% курят на данный момент. Индекс массы тела (ИМТ) колебался от 20,03 до 39,45 кг/м2 и в среднем составил 26,3±3,4 кг/м2. Отягощенная по инфаркту миокарда наследственность отмечалась у 19% лиц, по инсульту - 17%.
По данным УЗИ в среднем размеры камер сердца и диаметр сосудов шеи были в пределах нормы. Гипертрофия миокарда левого желудочка встречалась у 48%, а диастолическая дисфункция - у 61%. Эти отклонения в начальных стадиях были практически у всех обследуемых. Большинство пациентов с гипертрофией ЛЖ и диастолической дисфункцией имели диагноз АГ (81 и 92%). У 80% КИМ был в пределах нормы.
Исследование в условиях спортивной тренировки показало, что 48% из всех обследованных имели повышенное САД (выше 139 мм рт.ст.) и 42% - повышенное ДАД (выше 89 мм рт.ст.) еще до начала разминки. После тренировочной нагрузки повышенное САД регистрировалось почти с той же частотой (у 39%), а повышенное ДАД - у 36% спортсменов-ветеранов. Отмечались достоверная, но не абсолютная связь между АД до и после тренировки. Так, среди спортсменов с исходно нормальным ДАД у 17% после тренировки оно повысилось. У лиц с повышенным ДАД в 39% случаев после физической нагрузки наступила нормализация этого параметра. При исходно нормальном САД повышение произошло у 20% лиц, при этом физическая нагрузка "нормализовала" значения САД у 41% ветеранов спорта с исходно повышенным давлением.
Как видно из табл. 1, САД и особенно ДАД как до, так и после нагрузки были повышены почти у половины обследованных, причем чаще у спортсменов, страдающих АГ. Следует отметить, что немало - почти У3 лиц - без установленной АГ также имели повышенное АД до и после тренировки.
Что касается других изучаемых факторов кардиоваскулярного риска, зависимость от повышенного АД отмечалась только у ИМТ. Повышение АД до и особенно после тренировки ассоциировалось с относительно большим ИМТ. Повышенное после нагрузки САД было характерно для более возрастных лиц. В отношении пола, курения, отягощенного семейного анамнеза такой взаимосвязи не отмечалось.
При анализе данных ультразвукового исследования оказалось, что превышение нормы АД перед тренировкой с этими показателями практически не взаимосвязано. Отмечено лишь, что фракция выброса в среднем у лиц с повышением САД была статистически значимо (р<0,05) выше (71,4±3,9%), чем у лиц с нормотонией (68,4±3,5%), перед тренировкой.
У результатов измерения АД после нагрузки установлены значимые взаимосвязи с показателями УЗИ (табл. 2).
Повышенные значения САД ассоциировались с большей встречаемостью диастолической дисфункции, гипертрофии миокарда левого желудочка и, соответственно, относительно повышенным ИММЛЖ.
Повышение ДАД после нагрузки имело значительно больше ассоциаций с показателями УЗИ (табл. 3). Так, кроме значимой тенденции к диастолической дисфункции и гипертрофии левого желудочка, у лиц с повышением ДАД отмечались относительно большие размеры предсердий, а при исследовании сонных артерий - больший КИМ слева и тенденция к большим значениям КИМ справа.
Обсуждение
Увеличение количества обследованных в 2 раза по отношению к нашей предыдущей работе [11] не привело к существенному изменению результатов в отношении показателей АД. Среди исследуемых нами спортсменов наблюдается такая же распространенность АГ, как и среди населения РФ среднего и пожилого возраста, не имеющего отношения к спорту [20, 21]. Однако в данном исследовании выявляется повышение АД до и после тренировки среди спортсменов, успешно лечащихся от АГ. Также отмечалось повышение АД более 139 и 89 мм рт.ст. у части лиц, не имеющих диагноза АГ и не фиксирующих повышения АД в повседневной жизни. Частота этого явления практически совпадает с распространенностью маскированной АГ, выявленной при обследовании немолодых спортсменов [9] при суточном мониторировании АД. Возможно, именно с этим феноменом мы имели дело.
Следует отметить, что повышение АД до тренировки не обязательно обозначало, что оно будет повышенным и после. И, наоборот, у лиц с исходно нормальным АД после физической нагрузки фиксировалось повышенное АД.
Значительная частота и выраженность повышения уровня АД среди спортсменов с диагнозом АГ может свидетельствовать об относительно повышенном риске сердечно-сосудистых событий у данных спортсменов, возникающих на фоне стрессовой ситуации в условиях соревнований. Очевидно, повышенное давление у наших обследуемых до и после спортивных нагрузок можно считать повышенным лишь условно, поскольку нормы разработаны для состояния покоя и не существует четких рекомендаций по интерпретации значений АД в изучаемых нами условиях. В этой связи важно подтвердить допустимый уровень повышения АД перед тренировкой и в период раннего восстановления, т.е. ответить на вопрос о благоприятной и неблагоприятной реакции на спорт. Норму для офисного АД мы условно и несколько произвольно перенесли в условия тренировочного процесса. Однако выявленные тенденции (нормальное АД у половины спортсменов, зависимость результатов измерений от наличия АГ) в определенной мере позволяют опираться на установленные границы. Очевидно, для более точного разграничения необходимы очень крупные проспективные исследования. В ближайшие годы подобных результатов вряд ли стоит ждать. Более того, даже норма для офисного АД регулярно пересматривается [14, 22].
Сопоставление АД у наших обследованных с результатами УЗИ в некоторой мере подтвердило правомерность выбранного нами подхода.
Оказалось, что частота встречаемости гипертрофии левого желудочка (ГЛЖ) и диастолической дисфункции у спортсменов-ветеранов значительно не отличалась от показателей, характерных для пациентов с АГ сходного возраста [7]. Поскольку эти явления в основном отмечались у лиц с АГ, вряд ли такую ГЛЖ можно назвать спортивной.
Взаимосвязь между показателями УЗИ и АД до и после тренировки принципиально отличалась. Вероятно, должна отличаться и интерпретация измерений.
До тренировки САД выше 139 мм рт.ст. ассоциировалось с относительно высокой фракцией выброса (ФВ), что может отражать склонность кровообращения к гипердинамии. Не установлено никаких других существенных ассоциаций. В этой связи можно считать, что предстартовая гипертензия в большей мере отражает эмоциональный и вегетативный компонент и может не относиться к патологическим явлениям.
Что касается повышенного АД в ранний восстановительный период, очевидно, что это это неблагоприятный маркер. Ассоциация АД >139/89 мм рт.ст. с признаками гипертрофии и диастолической дисфункции левого желудочка подтверждает это. Не исключено, что гипертензивная реакция на нагрузку, и не только спортивную, внесла свой вклад в формирование выявленных изменений левого желудочка.
Следует отметить, что ДАД больше 89 мм рт.ст. может претендовать на роль более явного негативного показателя, ибо связано с относительно большими размерами предсердий и величиной КИМ. Более того, превышение нормальных значений КИМ отмечено только у лиц с повышенным ДАД после тренировки. И, напротив, у лиц с нормальным ДАД КИМ не выходил за пределы нормы.
Следовательно, ДАД >89 мм рт.ст. после нагрузки может служить индикатором неблагоприятных изменений в сердечно-сосудистой системе, в частности повышенного кардиоваскулярного риска, так как и ГЛЖ, и диастолическая дисфункция (ДД), и повышенный КИМ являются недвусмысленными его показателями.
Данное исследование не позволяет судить о том, полезны или вредны для лиц с такой реакцией АД, в частности для больных АГ, интенсивные занятия спортом. Отдельные исследования [2, 3] позволяют надеяться, что риск неблагоприятных событий у таких спортсменов как минимум не выше, чем у аналогичных больных АГ, не занимающихся физическими упражнениями.
Необходимость коррекции антигипертензивной терапии в том случае, когда офисное и измеренное дома АД нормальное, но повышено после тренировок, пока должна обсуждаться с учетом мнения экспертов. Обсуждение это весьма актуально, поскольку результатов крупных рандомизированных клинических испытаний по данной проблеме в ближайшие годы не ожидается.
Представляется, что в этом случае в отношении спортсменов с АГ и повышением АД после спорта можно обсуждать как минимум 3 варианта вмешательства:
1) возможность дополнительного приема короткодействующих антигипертензивных препаратов (каптоприл) непосредственно перед тренировками и соревнованиями; 2) смещение времени приема назначенных препаратов; 3) при выборе целевого офисного давления акцент на более агрессивные рекомендации AHA [22]. Варианты нам кажутся вполне приемлемыми, хотя четких показаний и критериев эффективности в этом плане пока не разработано, и проблема нуждается в дальнейшем изучении. В любом случае измерение, в том числе и самоизмерение, АД до и, особенно, после занятий спортом весьма полезно.
Выводы
1. Практически половина спортсменов среднего и пожилого возраста имеют диагноз "артериальная гипертензия".
2. Около трети спортсменов-ветеранов без зарегистрированной АГ отмечают повышение АД >139/89 мм рт.ст. как до, так и после физической нагрузки.
3. У спортсменов-ветеранов, по данным УЗИ, в среднем значения размеров камер сердца и характеристики сосудов шеи находились в пределах нормы. Гипертрофия миокарда левого желудочка встречалась у 48%, а диастолическая дисфункция у 61%, в основном у больных АГ.
4. Обращает на себя внимание, что, в отличие от повышения АД до спортивной нагрузки у спортсменов-ветеранов, повышение именно ДАД в ранний восстановительный период в большей мере ассоциируется с маркерами кардиоваскулярного риска: наличием гипертрофии левого желудочка, диастолической дисфункции и увеличением КИМ.
Конфликт интересов. Авторы заявляют об отсутсвии конфликта интересов.
Резюме
Бронхолегочная дисплазия (БЛД) и ретинопатия недоношенных (РН) - часто встречающиеся и довольно серьезные осложнения у недоношенных новорожденных. Эти заболевания объединяет формирование сосудистой патологии на фоне недоразвития органа. Поэтому резонно задать вопрос о том, могут ли факторы, влияющие на ангиогенез, играть общую патогенетическую роль в развитии обоих типов патологий. Ингибирование или индукция экспрессии единственного фактора ангиогенеза вряд ли в 100% случаев будет вызывать БЛД или РН либо защищать от них. Скорее всего имеет место взаимодействие множества факторов, ведущее к нарушению ангиогенеза, что повышает вероятность наличия общих патогенетических путей при обоих заболеваниях. В данном обзоре исследуется данная вероятность, для чего оцениваются данные, свидетельствующие в пользу участия отдельных факторов ангиогенеза в развитии сосудов и формировании сосудистой патологии при каждом рассматриваемом заболевании. Сформированы предположения о взаимодействии отдельных факторов, которые могут способствовать развитию как БЛД, так и РН, и там, где это возможно, описываются временные интервалы и последовательность развития связи между БЛД и РН. Авторы выражают надежду, что теории, выдвинутые в данном обзоре, вдохновят ученых на проведение исследований, направленных на углубление представлений о патогенезе обоих заболеваний.
Ключевые слова:бронхолегочная дисплазия, ретинопатия недоношенных, васкулогенез, недоношенность, ангиогенез
Список сокращений
БАЛ - бронхоальвеолярный лаваж
БЛД - бронхолегочная дисплазия
ИВЛ - искусственная вентиляция легких
ИЛ-6 - интерлейкин-6
ИФН-γ - интерферон-γ
ПМВ - постменструальный возраст
РН - ретинопатия недоношенных
αSMA - α-гладкомышечный актин
Ang2 - ангиопоэтин-2
eNOS - эндотелиальная NO-синтаза
IGF-1 - инсулиноподобный фактор роста 1
IGFBP-2 - белок-2, связывающий инсулиноподобный фактор роста
IGFBP-3 - белок-3, связывающий инсулиноподобный фактор роста
IGFBP-4 - белок-4, связывающий инсулиноподобный фактор роста
IGFBP-5 - белок-5, связывающий инсулиноподобный фактор роста
IP-9 и IP-10 - интерферон-у-индуцируемые протеины 9 и 10 массой 10 кДа
MIP-la/CCL3 - макрофагальный воспалительный белок-1а
MIF - фактор ингибирования миграции макрофагов
MMP2 - матриксная металлопротеиназа 2
MMP9 - матриксная металлопротеиназа 9
MCP-1/CCL2 - моноцитарный хемотаксический фактор 1
NO - оксид азота
PAPP-A - ассоциированный с беременностью протеин-А плазмы
PEDF - фактор дифференцировки пигментного эпителия
sFlt-1 - растворимая fms-подобная тирозинкиназа-1
sTie2 - растворимый Tie2 (тирозинкиназные рецепторы-2)
TGFβ - трансформирующий фактор роста β
THBS1 - тромбоспондин-1
VEGF - фактор роста эндотелия сосудов
VEGFR1 - рецептор фактора роста эндотелия сосудов 1-го типа
VEGFR2 - рецептор фактора роста эндотелия сосудов 2-го типа
Недоношенные новорожденные находятся в группе риска развития бронхолегочной дисплазии (БЛД) и ретинопатии недоношенных (РН). И, несмотря на достижения неонатальной медицины и результаты исследований в данной области, данные типы патологий продолжают оставаться статистически значимыми причинами развития осложнений и смертности среди недоношенных новорожденных. БЛД характеризуется нарушениями, выявляемыми в ходе формирования альвеол, а также снижением и нарушениями развития микрососудов альвеолярных стенок и ремоделированием ткани легких у недоношенных детей [1]. РН также связана с аномалиями сосудов сетчатки недоношенных детей [2]. И БЛД, и РН связаны со значимыми изменениями в передаче сигнала в клетке, которые влияют на регуляцию ангиогенеза [1, 2]. Часто у новорожденных развиваются оба заболевания. У БЛД и РН также выявляются многочисленные общие физиологические факторы риска в патогенезе [1, 2]. Все эти факты свидетельствуют в пользу наличия общих для БЛД и РН молекулярных путей. Баланс между проангиогенными и антиангиогенными сигнальными путями важен для контролируемого ангиогенеза и ремоделирования сосудов [3], однако мало известно о состоянии этого баланса при развитии БЛД и РН. Данный обзор сосредоточен на общих чертах БЛД и РН в отношении нарушения регуляции про- и антиангиогенных факторов, влияющих на развитие сосудов легких и сетчатки глаза. Цель обзора - сбор данных, свидетельствующих в пользу наличия общих или тесно связанных между собой механизмов патогенеза рассматриваемых патологий, даже несмотря на то что клинические признаки данных патологий могут появляться в разное время. На сегодняшний день биологические модели лабораторных животных, позволяющие одновременно изучать патогенез обоих заболеваний, отсутствуют, а данная тема в литературе подробно не обсуждалась. Выявление факторов ангиогенеза, общих для обоих заболеваний, может быть важным фактором для проведения будущих исследований, а также может помочь разработке терапевтической стратегии, направленной на профилактику развития патологического ангиогенеза как в легких, так и в сетчатке глаз.
Вероятно, изменения на клеточном уровне, которые невозможно выявить современными методами диагностики, происходят в легких и сетчатке недоношенных детей до момента, когда может быть поставлен клинический диагноз БЛД и РН. Такие ранние события могут помочь выявить молекулярные пути, общие для патогенеза как БЛД, так и РН, и найти общие механизмы в их возникновении и/или прогрессировании. Данный обзор сосредоточен на изучении медиаторов ангиогенеза, важных для развития легких и глаз, а также играющих роль в патогенезе БЛД и РН. Большинство исследований в данной области посвящено индукторам ангиогенеза. Однако ингибиторы ангиогенеза также важны как для нормального развития, так и для появления заболевания, поэтому в данном обзоре авторы уделяют им особое внимание. В таблице приведен список медиаторов ангиогенеза, обсуждение которых будет дано ниже. Сравнительная хроника клинических событий при развитии БЛД и РН отражена на рис. 1 и основана на существующих на сегодняшний день представлениях. Также на рис. 1 указаны сроки, в которые медиаторы развития сосудов, рассматриваемые в данном обзоре, проявляют активность при БЛД и РН, согласно предположениям авторов. На протяжении всего обзора авторы ссылаются как на временную шкалу, так и на таблицу.
У БЛД и РН есть общие важные факторы риска - перинатальное воспаление и воздействие окислительного стресса [1, 2, 4-6]. Кроме того, хотя с генетической точки зрения БЛД и РН не считаются независимыми прогностическими факторами в отношении друг друга, для обоих заболеваний характерна выраженная генетическая предрасположенность [7, 8]. Однако конкретные генетические факторы пока до конца не выяснены.
Кроме того, хотя наблюдаемые порядок и время развития БЛД и РН клинически хорошо задокументированы (см. рис. 1), неясно, есть ли сходство на клеточном уровне между временными показателями развития заболеваний. Частично это обусловлено невозможностью проведения клинического наблюдения за патологическими изменениями
в легких в режиме реального времени, в то время как наблюдать за сосудистыми изменениями в развивающемся глазу можно даже при визуальном осмотре. Из-за невозможности неинвазивного наблюдения за развитием патологии легких в настоящее время БЛД диагностируется исходя из таких критериев гестационного возраста и назначаемого лечения, а не по конкретным клиническим биомаркерам патологии легких [9]. Врачи должны знать, что обозначенные критерии не позволяют выявить всех пациентов с респираторными проблемами, обусловленными незрелостью легких и их повреждением. Не так давно эксперты потребовали пересмотра или уточнения текущего определения БЛД, чтобы оно оптимально отражало спектр новорожденных, находящихся в группе риска, в том числе детей с нарушениями регуляции дыхания и патологией дыхательных путей [10-12].
Нарушения в развитии сосудов сетчатки у недоношенных детей при РН носят двухстадийный характер (см. рис. 1). Первая стадия РН включает изменения в неоваскуляризации сетчатки с остановкой роста новых и регрессией уже существующих сосудов, а вторая характеризуется формированием сосудистой патологии и неоваскуляризацией в ответ на гипоксию сетчатки [2]. Этот двухстадийный процесс хорошо заметен у выживших детей с РН при осмотре сетчатки. С другой стороны, получение информации о нормальном развитии и формировании сосудистой патологии легких у живых новорожденных требует проведения инвазивных процедур, применение которых неоправданно. Однако результаты исследования М. De Paepe и соавт., в ходе проведения которого были использованы образцы, полученные при аутопсии, свидетельствуют в пользу двухэтапного характера развития кровеносных сосудов и аномалий их развития при БЛД, напоминающих нарушения при РН, в отличие от простой одноэтапной задержки развития сосудов, предполагаемой другими авторами [4, 13, 14]. На временном отрезке, приведенном на рис. 1, использована предложенная двухэтапная модель сосудистых изменений при РН и БЛД, приведены данные о гестационном и постнатальном возрасте для корреляции клинических и исследовательских данных.
Фактор роста эндотелия сосудов
В целом ряде исследований показано, что нарушение регуляции фактора роста эндотелия сосудов (VEGF) играет важную роль в патогенезе как БЛД, так и РН [1, 2, 15-21]. Экспрессия VEGF снижена в раннем постнатальном периоде у детей, родившихся в поздней каналикулярной или ранней альвеолярной фазе развития легких, когда дальнейшее развитие сосудов и дыхательных путей крайне важно для правильного формирования и функционирования альвеол и микрососудистой системы легких. J. Been и соавт. обнаружили статистически значимое снижение уровней VEGF в аспиратах из трахеи в 0-й и 3-й дни жизни у новорожденных, родившихся на сроке 28-29 нед гестации, у которых позднее развилась БЛД, что коррелировало с ранним снижением уровня белка VEGF в легких до постановки диагноза БЛД [22]. Интересно отметить, что те же дети (с измененными уровнями VEGF и БЛД) также получали более интенсивную дополнительную кислородную поддержку по сравнению с детьми, у которых БЛД не развилась. Использование кислородной поддержки у новорожденных при затруднениях с дыханием связано также с преждевременным снижением выработки VEGF в нормальной сетчатке [16]. Такое патологическое снижение уровня VEGF в сетчатке наблюдается на стадии I РН (с момента преждевременных родов примерно до 30-32 нед гестации), и его вероятность растет со снижением гестационного возраста при рождении [2, 17]. Таким образом, время стадии I РН может соответствовать времени, когда, согласно недавним исследованиям, наблюдается снижение экспрессии VEGF в легких (см. рис. 1). Однако на стадии II РН, которая начинается в постменструальном возрасте (30-32 нед), местная гипоксия сетчатки с дальнейшим развитием сетчатки приводит к тому, что экспрессия VEGF в сетчатке возобновляется, стимулируя формирование сосудистой патологии [17]. Этот переход от сниженной к повышенной экспрессии VEGF при РН был продемонстрирован также V. Bhandari и соавт., а также другими авторами на некоторых биологических моделях индуцированного кислородом повреждения легких, а также в исследованиях у человека [23, 24]. В аспиратах из трахеи новорожденных, у которых в дальнейшем развилась БЛД или наступил летальный исход, уровни VEGF были первоначально повышены (в первые 12 ч жизни), после чего отмечалось их снижение, а затем новое возрастание к 21-28-му дням [23].
В данном и других исследованиях использовали уровни кислорода, намного превышающие обычно необходимые в современной клинической практике, что ставит вопрос о том, соответствуют ли двухстадийные изменения уровней VEGF в легких, наблюдаемые в некоторых моделях у животных и в исследованиях у человека, двухстадийным изменениям в экспрессии VEGF, наблюдаемым у новорожденных с РН [17, 23, 24]. При этом нужно учитывать, что данные исследований у человека, в которых измеряли уровни VEGF при бронхоальвеолярном лаваже (БАЛ), не соответствуют по времени развития легких данным, полученным V. Bhandari и соавт. при измерении уровней VEGF при БАЛ у животных [21-24].
Эндогенные антагонисты VEGF привлекают внимание ученых как факторы, потенциально способные вносить вклад в развитие БЛД. Один из них - растворимая fms-подобная тирозинкиназа-1 (sFLt-1) присутствует в амниотической жидкости, и ее уровень статистически значимо повышен в случае диагностирования хориоамнионита и преэклампсии, при которых она провоцирует формирование сосудистой патологии, связанной с беременностью. Выдвинув предположение о том, что sFLt-1, экспрессирующаяся в период беременности, принимает участие в развитии БЛД у недоношенных новорожденных, B. Wallace и соавт. [25] разработали модели у крыс для более детального изучения данного предположения. Инъекция sFLt-1 в плодный пузырь у крыс приводила к изменениям в альвеолах и функции легких новорожденных крысят, аналогично наблюдаемым при БЛД, а также к появлению признаков гипертрофии правых отделов сердца. Инъекция эндотоксина в амниотическую жидкость крыс служила моделью хориоамнионита, при которой уровни sFLt-1 у новорожденных крысят были повышены. У этих крысят в первые дни жизни наблюдались признаки БЛД. Изменения, характерные для БЛД, устраняли введением в амниотическую жидкость антител к sFLt-1. Это исследование было проведено не так давно, и его результаты свидетельствуют в пользу возможности проведения терапии антителами для профилактики БЛД у недоношенных новорожденных, перенесших хориоамнионит во внутриутробном периоде [26].
Учитывая однозначную необходимость регулируемой экспрессии VEGF как при БЛД, так и при РН, исследователей интересует вопрос, может ли терапия РН инъекциями ингибиторов VEGF в стекловидное тело негативно повлиять на развитие сосудов легких ввиду наличия непредвиденных системных побочных эффектов [27]. Кроме того, все большую обеспокоенность вызывает тот факт, что методики, применяемые при терапии РН ингибиторами VEGF, не проходили тестирование в клинических исследованиях. Все это может только усугубить понимание связи между экспрессией VEGF и методами терапии, воздействующими на VEGF, при РН и БЛД [28]. Необходимо проведение новых исследований, которые будут направлены на установление более точных временных интервалов, в ходе которых VEGF влияет на развитие сосудов при БЛД и РН, а также требуется изучение вопроса о возможных последствиях терапии ингибиторами VEGF в определенных временных точках.
Полиморфизм VEGF
В некоторых исследованиях изучали однонуклеотидные полиморфизмы (ОНП) в гене VEGF как фактор риска БЛД и РН. В частности, таким возможным ОНП является полиморфизм 460C/T, картированный в регуляторных областях гена VEGF на хромосоме 6. У гаплотипов с данным полиморфизмом C→T активности VEGF [19]. Хотя возрастания активности VEGF (базальной или в ответ на стимуляцию) не наблюдалось, носительство аллеля - 460T являлось независимым фактором риска развития БЛД, примерно на 9% превышающим исходный уровень риска. В противоположность этому у новорожденных, гомозиготных по аллелю - 460C, наблюдался самый низкий риск развития БЛД. У большей доли новорожденных с тем же аллелем - 460C/T развивалась РН, что требовало назначения лечения, хотя повышения сывороточных уровней VEGF не наблюдалось. Это говорит о том, что местная экспрессия VEGF может быть более важным биомаркером, чем уровень VEGF в крови [29]. В другом исследовании после введения поправки на гестационный возраст, дополнительную кислородную терапию и пол гаплотипы гена VEGF-460TT/+405CC были связаны с повышенной вероятностью, а гапло-тип-460TT/+405GG - со сниженной вероятностью необходимости назначения лечения РН [16]. Авторы предположили, что корреляция между аллелями генотипов VEGF и развитием РН, а также РН, требующей лечения, может быть связана с неравновесным сцеплением с соседними ангиогенными генами с неизвестными алелями. Кроме того, было показано, что носительство аллеля - 634C>G независимо повышает риск БЛД и РН у новорожденных в Японии и Египте соответственно, в отличие от носительства аллеля 936CT [30, 31]. Хотя эти исследования были сосредоточены отдельно на БЛД и отдельно на РН, их сравнение предоставляет данные, подчеркивающие важность написания обзоров, обобщающих исследования, посвященные разным патологическим процессам. В совокупности результаты исследования уровней VEGF и полиморфизмов VEGF указывают на то, что уровни VEGF в сетчатке и бронхоальвеолярных областях, вероятно, имеют большее значение для развития заболевания, нежели уровни VEGF в крови, а уровни VEGF в плазме или аспирате трахеи, вероятно, являются гораздо более чувствительными прогностическими факторами риска заболевания. Не так давно схожие выводы об уровне биомаркеров в тканях и в крови были сделаны для бронхиальной астмы [32]. Описанные исследования уровней VEGF помогают обосновать важность проведения многоцентрового исследования роли полиморфизма гена VEGF в одновременном развитии БЛД и РН.
Эндотелиальная синтаза оксида азота
Одним из эффектов в отношении БЛД и РН, обусловленных измененными уровнями VEGF, является влияние VEGF на активацию рецептора к VEGF 2-го типа (рецептор фактора роста эндотелия сосудов 2-го типа, VEGFR2), стимулирующего выработку эндотелиальной синтазы оксида азота (eNOS) в клетках эндотелия [33]. eNOS отвечает за выработку оксида азота (NO), что в дальнейшем опосредует регуляцию дифференцировки эндотелиальных клеток-предшественниц, процессы апоптоза и дифференцировку в местах формирования сосудов [33]. Регулируемые NO процессы включают в себя, в частности, расслабление гладких мышц стенок сосудов, что приводит к вазодилатации и увеличению кровотока.
Также он ингибирует агрегацию тромбоцитов [34]. Воздействие кислорода (40-50%) статистически значимо снижало уровни eNOS и NO в колонии эндотелиальных клеток-предшественниц, выделенных из пуповинной крови недоношенного новорожденного. Авторы сделали вывод о том, что при развитии БЛД индуцированное кислородом снижение уровня VEGF нарушает сигнальный путь VEGF-NO, важный для развития сосудов и альвеол (рис. 2) [33]. В соответствии с полученными результатами ингибирование VEGFR у новорожденных крысят снижало экспрессию eNOS и, таким образом, выработку NO [1]. Введение NO при ингаляции может преодолеть эффекты симультанного длительного ингибирования VEGFR, предотвратив апоптоз эндотелиальных клеток легких, улучшив рост сосудов и стимулируя развитие альвеол [1, 33]. В противоположность этому в мыши ной модели РН процессы облитерации и пролиферации сосудистых ГМК становились статистически значимо менее выраженными при воздействии блокаторов eNOS, а также у мышей с отсутствием гена eNOS [35]. Как у eNOS-/- eNOS+/+ мышей при назначении газовой смеси с 75% кислорода в период между 7-м и 9-м днями беременности отмечалось снижение выработки VEGF. Такого рода снижение уровня VEGF у мышей eNOS-/- составляло 30%, в то время как у мышей eNOS+/+ 77%. Кроме того, у мышей ENOS-/- также наблюдалось статистически значимое снижение уровня неоваскуляризации за пределами сетчатки [36]. В глазном яблоке регуляция уровней NO и VEGF идет по принципу обратной связи: активация VEGFR2 через VEGF стимулирует активность eNOS, что ведет к образованию NO и последующему снижению экспрессии VEGF [36] (см. рис. 2). Рассмотренные различия в регуляции eNOS при развитии легких и сетчатки подчеркивают важность учета потенциального влияния на оба органа при разработке методов лечения, которые влияют на сигнальные пути с участием VEGF. Хотя терапия, которая снизит активность eNOS в глазу, может замедлить развитие РН, системные побочные эффекты способны негативно повлиять на рост кровеносных сосудов в легких.
Несмотря на оптимистические результаты исследований in vitro у крыс и человека по оценке терапии NO, метаанализы исследований, в которых применялась ингаляция NO у недоношенных новорожденных для предотвращения или лечения БЛД, не продемонстрировали какие-либо преимущества [15, 37-41]. Основным ограничением большинства метаанализов было отсутствие оценки влияния таких потенциально важных факторов, как пол, гестационнный возраст, расовая/этническая принадлежность, социальноэкономический статус и методы вентиляции легких. Кроме того, 14 исследований, включенных в эти метаанализы, невозможно было сравнить из-за различий, выявленных в других стандартных методиках и тактиках лечения, применяемых в центрах, на базе которых данные исследования проводились. Время проведения терапии NO также статистически значимо отличалось: от назначения ранней стандартной терапии до ранней и поздней резервной терапии, что еще сильнее ограничивало ценность рассматриваемых метаанализов [37]. L. Askie и соавт. попытались учесть характеристики пациентов и терапии, проведя анализ данных отдельных пациентов с использованием результатов многих крупнейших клинических исследований NO [15]. Вместо объединения совокупных данных каждого исследования они попытались добиться единообразия в определении характеристик пациентов, исходов и методов лечения, используя центральное хранилище исходных данных по каждому случайным образом выбранному участнику. Однако, несмотря на такой жесткий подход к анализу данных 11 исследований, NO по-прежнему не демонстрировал положительного эффекта при БЛД и в настоящее время не рекомендован для предотвращения или лечения данного заболевания. Представленный в настоящей работе метаанализ не включал оценку частоты равития легочной гипертензии при БЛД, которая все чаще признается ее серьезным осложнением [42, 43]. Таким образом, польза от введения NO для предотвращения развития или лечения легочной гипертензии, осложняющей течение БЛД, по-прежнему неоднозначна. Для настоящего обзора представляет интерес то, что L. Askie и соавт. включили тяжелую РН в качестве вторичного исхода в свой метаанализ и не выявили защитного действия NO в отношении тяжелой РН. Требуется проведение новых исследований, чтобы изучить связь между регуляцией NO и развитием БЛД и РН [15]. Будущие исследования должны учитывать возможное влияние таких факторов, как расовая принадлежность, тип дыхательной поддержки, тяжесть заболевания и время проведения терапевтических вмешательств [42, 44]. В недавно завершенном многоцентровом исследовании было показано: хотя применение NO с 5-го по 14-й дни жизни безопасно, оно не повышало уровень выживаемости детей с БЛД к постменструальному возрасту 36 нед. Авторы предположили, что клинически значимым фактором, повлиявшим на получение таких результатов, могло быть несбалансированное распределение по расовой принадлежности между группами плацебо и NO [44].
Инсулиноподобный фактор роста-1 и интерферон-γ
Плод получает инсулиноподобный фактор роста 1 (IGF-1) через плаценту и амниотическую жидкость. Концентрация IGF-1 в сыворотке значительно возрастает на протяжении III триместра беременности. При преждевременных родах такого наблюдающегося в норме роста сывороточного уровня IGF-1 не происходит, и с повышением внематочного гестационного возраста уровень IGF-1 продолжает снижаться [45, 46] (см. рис. 1). Более низкие уровни IGF-1 в сыворотке крови связаны с развитием как БЛД, так и РН [47]. В противоположность этому образцы тканей, взятые при аутопсии у недоношенных новорожденных с развившейся БЛД, показали, что уровни IGF-1 в ткани легких были значительно повышены по сравнению с легкими новорожденных, умершими вскоре после рождения. Повышение было особенно выражено в эпителии и мезенхимальной ткани [46]. Различия в уровне IGF-1 между сывороткой и пораженной тканью легких при развившейся БЛД могут быть обусловлены выработкой IGF-1 активированными альвеолярными макрофагами и моноцитами, индуцированной местным воспалением [46, 48].
Замедление повышения уровня IGF-1 в сыворотке в первые 4 нед после преждевременных родов является независимым фактором риска РН [2]. На стадии I РН низкие постнатальные уровни IGF-1 могут опосредовать формирование сосудистой патологии, в то время как на стадии II повышение уровней IGF-1 с увеличением постменструального возраста может способствовать патологически повышенной стимуляции экспрессии VEGF и патологической неоваскуляризации [2]. Возможно, раннее введение IGF-1 новорожденным могло бы отсрочить развитие стадии I, что, в свою очередь, могло бы предотвратить развитие стадии II [2].
На уровни свободного IGF-1 в сыворотке крови влияют ассоциированный с беременностью протеин-А плазмы крови (PAPP-A) и металлопротеиназа, стимулирующая диссоциацию комплекса IGF-1-IGFBP-2, -4 и -5 (2, 4 и 5 белки, связывающие инсулиноподобные факторы роста), увеличивая количество биодоступного IGF-1 [48] (рис. 3). PAPP-A вырабатывается фибробластами, эндотелиальными и гладкомышечными клетками, а гипоксический, окислительный и воспалительный стресс повышает его биологическую активность [49]. Таким образом, воспаление может играть ключевую роль в системном контроле уровней свободного IGF-1. Снижение уровня IGF-1 в тканях может достигаться за счет снижения уровней воспалительного и окислительного стресса в легких или снижения уровней интерферона гамма (ИФН-γ) и ингибитора PAPP-A [48]. Воспалительная реакция может также повышать уровень ИФН-γ и, как следствие, уровней ангиопоэтина 2 (Ang2), матриксной металлопротеиназы 9 (MMP9), индуцируемых ИФН-y белков 9 и 10, массой 10 кДа (IP-9 и IP-10) - все они являются мишенями регуляции ИФН-y и могут рассматриваться как потенциальные маркеры развития БЛД и РН [50].
Белок-3, связывающий инсулиноподобный фактор роста
Белок-3, связывающий инсулиноподобный фактор роста (IGFBP-3), является одним из основных регуляторов уровня свободного IGF-1. Также он обладает независимой IGF-1-подобной активностью. На рис. 3 представлены пути, на которые влияет IGFBP-3 и которые могут координировать различные виды защитного ответа при повреждении легких или сетчатки, индуцирующем патологическое ремоделирование сосудов. На рис. 3 также показаны некоторые точки, обычно рассматриваемые как терапевтические мишени. Подобно IGF-1, сывороточные уровни IGFBP-3 повышаются с увеличением гестационного возраста in utero, но могут снижаться постнатально в случае преждевременных родов [51]. IGFBP-3 стимулирует eNOS-опосредованное возрастание уровня NO в клетках эндотелия микрососудов легких и в гемопоэтических стволовых клетках за счет сигнального пути SR-B1-PI3K-Akt [52], который связывает пути, показанные на рис. 3, с путями, представленными на рис. 2. IGFBP-3 снижает частоту гибели эндотелиальных клеток и ослабляет воспалительную реакцию, снижая выработку ИФН-y и регулируемых им медиаторов воспаления. Кроме того, IGFBP-3 усиливает взаимодействия астроцитов с эндотелиальными клетками, усиливая нейроваскулярное взаимодействие и укрепляя барьерные свойства эндотелия [52]. Это действие IGFBP-3, вероятно, приводит к снижению проницаемости кровеносных сосудов и повышению уровня их зрелости [52]. На уровни IGFBP-3 влияет нутритивный статус, и они положительно коррелируют с набором массы тела и потреблением белка у новорожденных как с БЛД, так и без нее [51]. Достаточное поступление энергетических субстратов у недоношенных новорожденных способствует нормальному росту и развитию легких, функционированию иммунной системы, улучшает показатели переносимости кислорода и положительно влияет на восстановление легочной ткани после повреждения [51].
У недоношенных новорожденных с диагностированной РН сывороточные уровни IGFBP-3 в ниже, чем у новорожденных без РН [52]. У мышей с делецией гена IGFBP-3, в течение 5 сут получавших повышенные уровни кислорода, снижение числа сосудов сетчатки было выражено сильнее, чем у мышей из группы контроля [53]. В сетчатке мышей, которым вводили IGFBP-3 с последующим назначением смеси с 75% содержанием кислорода, отмечалось статистически значимое снижение уровня гибели клеток эндотелия в среднепериферической и периферической зонах сетчатки на обоих стадиях РН [52].
В целом результаты рассмотренных исследований говорят о том, что системное возрастание уровня IGFBP-3, потенциально достигаемое путем оптимизации питания новорожденных, могло бы предотвратить или замедлить прогрессирование БЛД за счет повышения eNOS-опосредованной выработки NO в эндотелиальных клетках микрососудов легких путем уменьшения степени воспаления, снижения уровня ИФН-y и активации мишеней ИФН-y, с одновременной поддержкой благоприятных эффектов IGF-1 (см. рис. 2, 3). Сходным образом IGFBP-3 может замедлять прогрессирование РН посредством подавления облитерации и патологической пролиферации сосудов сетчатки. К сожалению, в идущих в настоящее время исследованиях фазы I и II по оценке применения рекомбинантных IGF-1/IGFBP3 для профилактики РН пока не выявлено различий в тяжести РН, однако заметна тенденция к менее тяжелому протеканию БЛД в группе лечения. Однако эти исследования не обладали достаточной статистической мощностью для оценки частоты или тяжести БЛД [28] (NCT 01096784). Помимо IGF-1/IGFBP3 взаимодействий, понимание того, как ИФН-у, PAPP-A, Ang2, MMP9, IP-9 и IP-10 взаимодействуют между собой при БЛД и РН, может помочь в разработке новых методов лечения, которые будут нацелены одновременно на оба заболевания, поддерживая при этом нормальное развитие тканей или не мешая ему (см. рис. 3).
Ангиопоэтины
Ангиопоэтины являются важными модуляторами физиологической и патологической неоваскуляризации. Их синтез тесно связан с синтезом VEGF [54]. Ангиопоэтины (Ang) 1 и 2 взаимодействуют с рецептором Tie2, экспрессия которого ограничена в основном мембранами эндотелиальных клеток [18]. Связывание Ang1 с Tie2 индуцирует фосфорилирование тирозина, способствуя выживанию и созреванию клеток эндотелия и укреплению межклеточных контактов между ними, что ведет к стабилизации сосудов (рис. 4). Уровни Tie2 были статистически значимо снижены в образцах фетального легкого, взятых при аутопсии у новорожденных, которые находились на искусственной вентиляции легких, с постменструальным возрастом от 25 до 27 нед, что указывает на снижение опосредуемой Ang1 передачи сигналов [13]. Взаимодействие Ang1 с VEGF важно для нормального созревания сосудов. Поэтому интересно отметить, что введение VEGF и Ang1 в качестве комбинированной генной терапии новорожденным крысятам стимулировало рост легких и созревание сосудов более эффективно, чем терапия только VEGF [18].
Ang2 препятствует действию Ang1, снижая уровни фосфорилирования тирозиновых остатков Tie2, что ведет к дестабилизации контактов между эндотелиальными клетками, транссудации жидкости и образованию новых сосудов [18, 55] (см. рис. 4). Ang2 также может взаимодействовать с VEGF, стимулируя ангиогенез в условиях гипоксии. Кроме того, Ang2 может вызывать гибель эндотелиальных клеток и регрессию сосудов в отсутствие достаточно сильных проангиогенных сигналов [55], что связывает между собой механизмы, рассматриваемые на рис. 2 и 4. Этот последний эффект Ang2 в отсутствие достаточных проангиогенных сигналов - возможный сценарий развития БЛД и РН.
Наблюдаются схожие временные изменения в экспрессии Ang1 и Ang2 при БЛД и РН (см. рис. 1). Экспрессия Ang1 снижена у новорожденных с развившейся БЛД и с прогрессирующей РН, в то время как экспрессия Ang2 повышена в аспиратах трахеи новорожденных с развившейся БЛД и в жидкости стекловидного тела новорожденных с прогрессирующей РН [54, 55]. У новорожденных с гестационным возрастом <30 нед, у которых в дальнейшем развивалась умеренная БЛД или симптоматика при приближении летального исхода указывала на ее развитие, уровни Ang2 в аспиратах трахеи были статистически значимо выше на 1-й и 7-й дни жизни, а в ряде исследований - вплоть до 10-го дня жизни [55, 56]. Среди новорожденных с РН и средним гестационным возрастом при рождении, составлявшем 24,2 нед, у детей с РН стадии IV и уровнем активности неоваскуляризации от незначительной до высокой были статистически значимо выше уровни как Ang1, так и Ang2 в стекловидном теле по сравнению с новорожденными из контрольной группы. Однако повышение уровня Ang2 было выражено намного сильнее, чем уровня Ang1 [54]. Выше-обозначенные исследования показали, что и при БЛД, и при РН отношение Ang1 к Ang2 смещено в пользу антиангиогенного Ang2; данное нарушение равновесия может способствовать формированию сосудистой патологии как в легких, так и в глазах. Подобное формирование сосудистой патологии нельзя зафиксировать в живом легком, однако данные M. DePaepe и соавт. указывают на то, что, как и в незрелой сетчатке, в легких ребенка после преждевременных родов также наблюдаются патология и снижение темпов формирования сосудов [57].
Эндотелиальные клетки обладают способностью менять баланс активности между Ang1 и Ang2. Протеолитическое отщепление внеклеточного домена Tie2 приводит к высвобождению мембранного растворимого Tie2 (sTie2) из эндотелиальных клеток (см. рис. 4). Связывание sTie2 со свободными Ang1 и Ang2 препятствует связыванию этих факторов роста с интактным мембранным Tie2, изменяя функцию эндотелиальных клеток при васкуляризации; sTie2 обладает более высокой аффинностью к Ang1 [55] (см. рис. 4). Следовательно, высокие концентрации sTie2 могут сдвигать соотношение Ang1/Ang2 в сторону действия Ang2, способствуя системной и легочной активации эндотелиальных клеток и неоангиогенезу [55].
Возможно, что снижение концентрации sTie2 путем ингибирования протеолитического отщепления внеклеточного домена будет оказывать благоприятное действие при терапии БЛД и РН, сдвигая отношение Ang1/Ang2 в сторону активности Ang1, способствуя стабилизации формирующихся сосудов и в то же время поддержанию образования новых сосудов, опосредуемого Ang2, снижая таким образом чувствительность к кислороду в отношении роста сосудов. Наконец, у женщин с выявленным внутриамниотическим воспалением были выявлены более высокие уровни Ang2 в амниотической жидкости; это говорит о том, что снижение воспалительной реакции в период беременности также могло бы снизить активность Ang2 у недоношенного ребенка [55] (см. рис. 3, 4).
Трансформирующий ростовой фактор β
Члены семейства трансформирующего фактора роста β (TGFβ) передают сигнал через димеры TGFβ рецепторов 1-го и 2-го типа и играют ключевую роль в регуляции роста, дифференцировки и миграции клеток, а также синтеза белков внеклеточного матрикса; все эти события важны для развивающегося плода и новорожденного, в том числе регуляция роста сосудов [58]. Значительное количество исследований посвящено роли TGFβ в развитии легких: как физиологической, так и патологической. На ранней стадии развития легких TGFβ принимает участие в контроле морфогенеза ветвления дыхательных путей, однако избыток TGFβ подавляет процесс ветвления [46, 59]. На более поздней стадии развития легких TGFβ ингибирует созревание альвеолярных клеток 2-го типа [60, 61]. Постоянная гипероксия в легких крыс ведет к статистически значимому возрастанию уровней активного TGFβ при БАЛ и статистически значимому возрастанию экспрессии рецепторов TGFβ I и II [59].
Повышенная экспрессия TGFβ1 у новорожденных крысят негативно влияет на формирование альвеол, в то время как физиологически нормальные уровни TGFβ1 уменьшают явления апоптоза, способствуют репарации в альвеолярных клетках 2-го типа после гипероксии и стимулируют экспрессию α-гладкомышечного актина (αSMA), что положительно влияет на процессы созревания в капиллярах и снижает проницаемость их стенок. Недавнее исследование A. Sureshbabu и соавт. показало, что TGFβ-опосредованные процессы апоптоза, воспаления, замедления формирования альвеол и нарушения ангиогенеза в модели БЛД у мышей проходят с непосредственным участием рецептора TGFβ 2-го типа (TGFβR2) [62]. У недоношенных новорожденных, подключенных к аппарату искусственной вентиляции легких (ИВЛ), в аспиратах трахеи повышены уровни TGFβ1 (как активной, так и неактивной формы) по сравнению с детьми схожей возрастной группы, которым ИВЛ не была назначена [22]. Однако функция, которую выполняет TGFβ1 в легочной ткани, довольно сложна и часто выглядит противоречиво. Например, TGFβ1 улучшает показатели выживаемости альвеолярных клеток 2-го типа в культуре клеток, взятых у крыс [63].
Рецепторы 1-го и 2-го типа присутствуют на эндотелиальных клетках сосудов и перицитах формирующейся сосудистой сети сетчатки грызунов; это указывает на то, что регуляция рецептора TGFβ прямо влияет на рост сосудов сетчатки [58]. S. Shih и соавт. оценили связь между экспрессией TGFβ1 и уязвимостью перед вызванными гипероксией изменениями сосудов сетчатки в эндотелии ретинальных сосудов быка и новорожденных мышат [64]. Экспрессия VEGFRl-рецептора (рецептор фактора роста эндотелия сосудов), ключевого фактора выживаемости сосудов, в бычьих клетках эндотелия сосудов сетчатки при воздействии на них TGFβ1 была увеличена в 6,5 раза по сравнению с контролем. Также было проведено исследование на новорожденных мышатах, в течение 24 ч подвергавшихся воздействию гипероксии (FiO2 0,75). Такая степень гипероксии снижала уровни TGFβ1 и VEGFR1 в сетчатке на треть. Введение TGFβ1 после 17 ч гипероксии положительно влияло на показатели роста сосудов сетчатки. У таких получавших TGFβ1 мышей в сетчатке сохранялось больше капилляров, чем у мышей из группы контроля. TGFβ1 также индуцировал экспрессию αSMA в перицитах. Перициты в сосудистом русле сетчатки экспрессируют αSMA. Точнее, перициты зрелых сосудов сетчатки всегда экспрессируют αSMA, но лишь некоторая доля перицитов экспрессирует αSMA в период, когда происходит неоваскуляризация сетчатки. Важно подчеркнуть, что сосуды сетчатки, перициты которых экспрессируют αSMA, устойчивы к индуцированному кислородом снижению числа сосудов [64, 65]. Согласно работе S. Shih и соавт. [64], TGFβl-опосредованная индукция VEGFR1 и αSMA может защищать незрелую сетчатку от индуцированного гипероксией ингибирования неоваскуляризации - стадии I развития РН (см. рис. 1). αSMA - важный фактор стабилизации новых сосудов [64, 65]. При РН созревание сосудов может быть замедлено или ослаблено в силу отсутствия VEGFR1, обусловленного сниженной экспрессией TGFβ1 перицитами [64]. В противоположность этому в другой работе были получены результаты, показавшие, что ангиогенное действие TGFβ сопровождалось появлением воспалительного инфильтрата вместо повышения экспрессии VEGFR1 [58]. Авторы данного исследования предположили, что наличие TGFβ в сетчатке обусловлено воспалительным ответом, индуцированным гипероксией, поскольку TGFβ1 не стимулировал ангиогенез при отсутствии воспаления [66].
Эндоглин - это индуцируемый гипоксией добавочный рецептор для TGFβ, который экспрессируется преимущественно в пролиферирующем эндотелии сосудов. Его экспрессия сильно повышена в микрососудах ткани легких, что было выявлено в ходе проведения аутопсии у недоношенных новорожденных, находившихся на ИВЛ [13, 67]. Биология эндоглина, как и биология TGFβ, довольно сложна. Этот белок существует в мембранной и в более короткой растворимой форме, связывающей TGFβ и оказывающей действие, противоположное действию мембранной формы белка. У эмбрионов крыс, которым вводили вектор, экспрессирующий растворимую форму эндоглина, путем инъекции в плодный пузырь в 14-й день эмбрионального развития, отмечались статистически значимо повышенные уровни эндоглина в легких в возрасте 2 нед. В легких наблюдалось прекращение развития микрососудистого русла и альвеолярных структур, что было схоже с картиной БЛД у человека [68, 69].
Эндоглин также является медиатором развития РН. У новорожденных мышат, подвергнутых воздействию гипероксии в 1-ю неделю жизни, развивается ретинопатия, связанная с неоваскуляризацией, которая может служить моделью РН у человека. Однако у новорожденных мышат с гаплонедостаточностью по эндоглину в тех же условиях отмечались значительно сниженные показатели в отношении неоваскулярной ретинопатии [70]. Модель РН у новорожденных крысят, подвергнутых воздействию гипероксии, показала, что снижение уровня эндоглина в сосудах сетчатки (достигнутого путем введения антител) блокировало неоваскуляризацию, развивающуюся в ответ на гипероксию. Тот же эффект наблюдался при блокировании действия VEGF в ходе терапевтического введения антител [71]. В данном исследовании было подтверждено, что для VEGF-опосредованной стимуляции неоваскуляризации необходимы повышенные уровни эндоглина, и это при том, что VEGF - один из основных активаторов неоваскуляризации при РН.
В целом ряде исследований у животных и человека указывают на комплексное участие сигнального пути TGFβ в патофизиологии БЛД и РН. Дополнительные исследования должны, вероятно, уделять больше внимания эндоглину, αSMA и VEGFR-1, что позволит четко определить роль TGFβ. Поскольку физиологические уровни TGFβ1, по-видимому, оказывают положительное действие на развитие сосудов легких и сетчатки, проведение исследований, ориентированных на поддержание физиологических уровней TGFβ у недоношенных новорожденных, может стать ценной стратегией для разработки новых терапевтических подходов.
Супероксиддисмутаза
В последнее время появляется все больше данных о том, что уровни антиоксидантов важны для защиты нормального ангиогенеза в легких и глазах. Уровни антиоксидантов у плода возрастают in utero в III триместре беременности. Таким образом, поскольку риск развития БЛД или РН наиболее высок у детей, родившихся в начале III триместра, у них неизбежно низок уровень антиоксидантов, повышена чувствительность к повреждению клеток активными формами кислорода [72, 73]. Супероксиддисмутазы (СОД) - это семейство белков, предотвращающих повреждение клеток путем катализирования снижения уровня супероксидного радикала (О2-), уровни которого повышаются в ходе гипероксии или реперфузии. У млекопитающих 3 типа СОД: СОД1, или цитоплазматическая СОД, СОД2, или митохондриальная СОД, СОД3, или внеклеточная СОД. СОД1 и СОД 3 требуют присутствия таких микроэлементов, как Zn и Cu, в качестве кофакторов (CuZn-СОД). СОД3 теснее связана с развитием БЛД и РН, чем другие типы СОД [74, 75]. Трансгенные мыши с удаленной кодирующей областью гена СОД3 развивались и взрослели нормально. Несмотря на отсутствие белка СОД3, у них не отмечалось повышения уровней белков СОД1 и СОД2. У этих мышей отмечались статистически значимо более сильное повреждение легких и сниженный уровень выживаемости после воздействия 1,0 FiO2 по сравнению с мышами с нормальным геном, кодирующим СОД3 [76]. Хотя введение глубоконедоношенным детям рекомбинантной CuZn-супероксиддисмутазы человека (рчСОД3) не снижало частоту развития БЛД, длительное последующее наблюдение выявило статистически значимое снижение частоты хронических заболеваний легких у детей, получавших фермент (обычно речь шла о бронхиальной астме) [73, 74, 77]. Достаточно тяжелые формы респираторных заболеваний, чтобы назначить лечение препаратами против бронхиальной астмы, отмечались у 23% детей, получавших рчСОД3, по сравнению с 36% детей в контрольной группе, получавших плацебо [77]. Максимальный эффект наблюдался у детей, гестационный возраст при рождении которых был <27 нед. В данной группе препараты для лечения бронхиальной астмы требовались 19% детей, получавших рчСОД3, по сравнению с 42% детей в контрольной группе. Кроме того, в группе, получавшей рчСОД3, отмечалось снижение числа госпитализаций на 44% и на 55% - числа обращений в приемное отделение больниц ко второму году жизни [77]. Рассмотренное исследование также подчеркивает важность проведения длительного последующего наблюдения при выборе способов профилактики БЛД ввиду его важных отдаленных последствий [74]. Данные когорты участников того же исследования были повторно проанализированы в отношении влияния терапии рчСОД3 на развитие РН. В целом статистически значимых различий в частоте развития РН между группами рчСОДЗ и плацебо не отмечено. Однако при стратификации по степени недоношенности у детей с гестационным возрастом <26 и 25 нед отмечалось снижение частоты развития РН на 22 и 53% соответственно. Кроме того, РН, тяжесть которой превышала II стадию, развилась только у 25% детей в группе, получавшей рчСОД3, по сравнению с 42% в контрольной группе [78]. В пользу защитного действия СОД3 в отношении васкуляризации сетчатки также свидетельствуют результаты исследований, в которых используются биологические модели РН. Гипероксия статистически значимо снижает уровни СОД3 в сетчатке в биологических моделях БЛД и РН. На трансгенных мышей, у которых экспрессировались повышенные уровни СОД3, воздействовали кислородом (0,75 FiO2) в течение 5 дней; у этих мышей было выявлено статистически значимо меньше новых сосудистых пучков за пределами сетчатки, чем у мышей из группы контроля с нормальными уровнями СОД3 [79]. В целом эти исследования указывают на возможную корреляцию между окислительным повреждением и механизмами развития БЛД и РН, связанную со снижением уровня СОД3.
Витамин A
Витамин A важен для правильного развития легких и глаз; он контролирует пролиферацию эндотелиальных клеток, необходимую для ангиогенеза, а также обладает многими другими функциями [80, 81]. Исследованиям, в которых изучается дополнительный прием витамина A с целью снижения частоты развития БЛД и РН, а также тяжести их проявлений, уделяется значительное клиническое внимание. Для недоношенных детей характерен дефицит витамина A, поскольку его значительная часть проникает через плацентарный барьер в III триместре беременности (см. рис. 1). Низкие уровни витамина A в плазме у таких детей в первые недели жизни связаны с развитием БЛД [80, 82]. На развитие сосудов в легких и глазах отчасти влияет активный метаболит витамина A - ретиноевая кислота, которая подавляет экспрессию VEGF и TGFβ, одновременно стимулируя передачу сигнала, опосредуемую VEGFR2, в эндотелиальных клетках [80, 82, 83], что связывает регулирующее действие витамина A с механизмами, которые обсуждались в связи с сигнальными путями, приведенными на рис. 2, и в разделе, посвященном TGFβ. Витамин A также увеличивает число зрелых альвеол [84]. В модели фетальной гипоплазии легких у крыс введение самкам крыс витамина A в период беременности стимулировало формирование альвеол во внутриутробном периоде и постнатальный альвеологенез при гипоплазии легких плода/новорожденных [84]. Поскольку механизмы ангио- и альвеологенеза, по-видимому, связаны, витамин A может оказывать значительное влияние на развитие БЛД. Однако несмотря на то что его важные функции четко показаны в биологических моделях на животных, в клинических исследованиях дефицита витамина A у недоношенных новорожденных в первые недели после рождения, где использовалось парентеральное введение в дозе 5000 МЕ 3 раза в неделю в первые 28 дней жизни, выявлено, на удивление, незначительное снижение частоты БЛД и уровня смертности [84]. Кроме того, при длительном последующем наблюдении положительного эффекта не выявлено [82].
Введение витамина A недоношенным новорожденным в первые недели жизни улучшало функцию сетчатки (определялось как повышение чувствительности палочек), вероятно, вследствие своей важной роли в регуляции формирования светочувствительного пигмента сетчатки, а не вследствие стимуляции роста ее сосудов [81, 85]. В модели РН у крыс введение ретиноевой кислоты статистически значимо снижало уровни VEGF по сравнению с крысами с РН, которые ее не получали [83]. Это также говорит о связи между механизмом действия витамина A и сигнальными путями, описанными на рис. 2. В метаанализе 3 клинических исследований было выявлено, что введение витамина A недоношенным новорожденным сопровождалось тенденцией к снижению частоты РН, однако данный эффект не был статистически значимым [81].
Таким образом, как и в случае клинических исследований БЛД, в настоящее время исходы исследований по дополнительному введению витамина A с целью снижения частоты РН разочаровывают. Как терапия витамином A может способствовать подавлению развития БЛД и РН, пока неясно. Необходимо дальнейшее изучение таких вопросов, как дозы, время и способ введения, а также наилучшая лекарственная форма. Кроме того, сочетание введения витамина A с другими методами терапии, включающими участие рчСОД3 или оксида азота, может улучшить как краткосрочные, так и отдаленные клинические исходы. В поддержку этой концепции в недавнем ретроспективном исследовании выдвинуто предположение о том, что витамин A и оксид азота синергично улучшают исходы в отношении легких и развития нервной системы у детей с экстремально низкой массой тела при рождении (<749 г) [80]. К сожалению, данные об эффекте в отношении РН не представлены.
Тромбоспондин-1
Тромбосподин-1 относится к семейству кальций-связывающих гликопротеинов внеклеточного матрикса, участвующих в регуляции межклеточных взаимодействий и взаимодействий между клетками и внеклеточным матриксом; в основном он локализован в сосудах малого и среднего калибра [13, 87]. Белок содержит проколлаген-подобный домен и несколько дупликаций типа I; они воздействуют на клетки эндотелия и гладкомышечные клетки сосудов, оказывая свойственное белку антиангиогенное действие [87]. Хотя влиянию тромбоспондина-1 при БЛД и РН посвящено мало исследований, имеющиеся данные говорят о том, что он участвует в патогенезе обоих заболеваний. Уровень тромбоспондина-1 измеряли в образцах ткани легких, полученных при аутопсии у недоношенных новорожденных, находившихся на ИВЛ, с гестационным возрастом на момент рождения 25-27 нед. Экспрессия тромбоспондина-1 была повышена в 5,5 раза по сравнению с экспрессией в легких детей с тем же гестационным возрастом, которым не проводилась ИВЛ. Повышение экспрессии наблюдалось в интерстициальной ткани легких, причем довольно высокий уровень тромбоспондин-1-позитивных тромбоцитов наблюдался в сосудах легких, подвергавшихся влиянию ИВЛ, в отличие от легких, не подвергавшихся такому воздействию [13]. Повышенная экспрессия тромбоспондина-1 в интерстициальной ткани незрелых легких, на которые воздействовала гипероксия или воспалительные стимулы, в дополнение к местному высвобождению тромбоспондина-1 из тромбоцитов, пересекающих капиллярное русло легких и его активации, - обоснованный механизм того, как тромбоспондин-1 может способствовать характерному для БЛД снижению ангиогенеза, с возможной связью с сигнальными путями, приведенными на рис. 3, за счет воспалительных сигналов.
Для изучения эффектов тромбоспондина-1 при РН новорожденных крыс линии Спрег-Доули подвергали воздействию 50 и 10% кислорода 24-часовыми циклами в течение 2 нед, чтобы воссоздать стадии РН, сопровождающиеся гипер- и гипоксией сетчатки. Если за этим воздействием следовала инъекция тромбоспондина-1, сразу или через 3 дня после перевода крыс на комнатный воздух отмечалось зависимое от дозы тромбоспондина-1 снижение неоваскуляризации сетчатки у крыс, которым инъекция была сделана сразу после перевода на комнатный воздух, по сравнению с крысами из группы контроля [87]. Тромбоспондину-1 и его эффектам при РН посвящено очень мало исследований у человека, но, основываясь на моделях РН у крыс, обсуждавшихся выше, можно предположить потенциальную роль этого белка в ангиогенезе и созревании сосудов, что служит обоснованием для будущих исследований тромбоспондина-1 как возможного медиатора при развитии БЛД и РН.
Фактор дифференцировки пигментного эпителия
Фактор дифференцировки пигментного эпителия (PEDF) - это нейропротекторный фактор роста, обладающий выраженными антиангиогенными свойствами; таким образом, представляет интерес его механизм действия при БЛД или РН. PEDF назван по слою клеток ретинального пигментного эпителия, где он был первоначально обнаружен. Последующие исследования показали, что PEDF вырабатывается клетками эпителия многих органов и прямо противодействует индуцируемой VEGF неоваскуляризации [88]. В модели БЛД у мышей, включавшей постоянное воздействие гипероксии на этапе альвеоляризации, отмечалось снижение уровня VEGF и заметное повышение уровня PEDF в легких. У трансгенных мышей, лишенных PEDF, была защита от индуцированных гипероксией изменений в упрощенной альвеоляризации и микрососудистого ремоделирования в легких; это говорит о том, что индукции PEDF кислородом достаточно, чтобы получить структурные характеристики легких, соответствующие рассматриваемой модели БЛД [89].
Уровни PEDF были повышены в ходе аваскулярного этапа развития РН в сетчатке новорожденных крысят, которых 1 раз в сутки переводили из режима гипероксии в режим гипоксии и обратно [90] (см. рис. 1). Соотношение количества белка PEDF с количеством белка VEGF было статистически значимо повышено до возраста 14 дней жизни, что отражает повышенное количество PEDF на аваскулярном этапе РН. В дальнейшем с переходом от аваскулярной фазы к фазе пролиферации уровни PEDF снижались, предположительно снимая ингибирование активности VEGF, таким образом, через 18 дней после рождения ученые наблюдали неконтролируемую неоваскуляризацию, что в итоге обусловливало итоговый фенотип, характерный для РН [91]. У разных линий крыс предрасположенность к развитию РН была разной. Повышение уровней VEGF и VEGFR2 отмечалось для всех линий крыс, подвергнутых циклам гипер-/гипоксии в неонатальном периоде, но уровень PEDF был повышен только у кислород-чувствительных штаммов, у которых развивалась РН [92].
Гипероксия индуцирует экспрессию матриксных металлопротеиназ MMP2 и MMP9 в клетках легких и сетчатки мышей [93-95]; PEDF является мишенью для обеих протеиназ, и MMP2, и MMP9 [95], что связывает регуляцию PEDF с сигнальными путями, показанными на рис. 2, и с эффектами воздействия 02. У мышей с генетическим снижением экспрессии MMP2 отмечалось снижение неоваскуляризации сетчатки в гипероксической модели РН, и это согласуется с наблюдением постоянной активности PEDF, являющейся следствием того, что он не расщепляется протеиназами [94]. В том же исследовании не выявлено влияния генетического снижения экспрессии MMP9 на индуцированную кислородом ретинопатию. PEDF способствует метаболизму кислород-содержащих радикалов, повышая уровни глутаминсинтетазы и переносчика 1-глутаматаД-глутамата у новорожденных мышей с индуцированной кислородом ретинопатией [96]. Влияние на уровни PEDF через инъекции лекарственных препаратов в стекловидное тело изучалось в качестве возможного подхода к профилактике РН. Например, инъекции эндостатина или бевацизумаба в сетчатку новорожденных мышат сразу же после 5 дней гипероксии восстанавливали соотношение PEDF/VEGF, повышая уровень PEDF; в такой сетчатке не развивались изменения, характерные для РН, связанные с формированием новых кровеносных сосудов [97, 98]. Дальнейшие исследования, посвященные тромбоспондину-1, PEDF и другим антиангиогенным факторам, могли бы способствовать более обобщенному пониманию патогенеза БЛД и РН и более унифицированным клиническим подходам к их профилактике и лечению, направленным на достижение более физиологического баланса между развитием сосудов и их стабилизацией.
Существует ли патогенетическая связь между бронхолегочной дисплазией и ретинопатией недоношенных?
Выводы и предложения по направлениям дальнейших исследований
Хотя в данном обзоре представлены весомые данные в поддержку гипотетической связи между патогенезом БЛД и РН, очевидно, что существуют другие потенциальные факторы, помимо обсуждавшихся, которые могут иметь значение для одного или для обоих этих заболеваний. Современные представления о таких факторах в дополнение к представленным в данном обзоре отражают растущую потребность в дальнейших исследованиях. Данный обзор сосредоточен на основных ангиогенных и ангиостатических факторах роста. Другие факторы, влияющие на ангиогенез, например фактор роста фибробластов 1 (FGF-1) и тромбоцитарный фактор роста (PDGF), не обсуждались, поскольку они могут регулировать ряд других процессов, помимо ангиогенеза. Тем не менее эти факторы тоже должны учитываться как возможные звенья, связывающие между собой механизмы развития БЛД и РН [99-103]. Авторы также не обсуждали ряд определенных факторов воспаления, которые, как правило, не входят в число основных регуляторов ангиогенеза. Однако медиаторы воспаления могут влиять на ангиогенез путем регуляции обсуждавшихся в данном обзоре факторов. В число регуляторов воспаления, упоминаемых при патогенезе как БЛД, так и РН, входят моноцитарный хемотаксический фактор 1 (MCP-1/CCL2), макрофагальный воспалительный белок 1α (MIP-1 α/CCL3), интерлейкин-6 (ИЛ-6) [5, 6, 104-108] и фактор ингибирования миграции макрофагов [109-111]. Наконец, такие факторы, как аргиназа II, НАДФН-оксидаза и эритропоэтин, также участвуют в развитии БЛД и РН [107, 112-118].
В данном обзоре изучалась возможность перекрывания механизмов развития БЛД и РН, связанных с процессами нарушения регуляции ангиогенеза. Ни один ангиогенный или ангиостатический фактор не может по отдельности полностью отвечать за патогенез и того, и другого заболевания, однако многие факторы, по-видимому, вовлечены в этот процесс в какой-то степени. Кроме того, имеющиеся на сегодняшний день литературные данные не позволяют связать обсуждавшиеся факторы регуляции роста сосудов в одну принципиальную схему, которая будет работать только для легких, или только для глаз, или для легких и для глаз сразу, чтобы определить механизм нормального и патологического васкулогенеза в обоих органах. Однако в данном обзоре собрана информация, которая может быть полезной для выявления потенциальных мишеней терапии, направленной на одновременное снижение частоты развития БЛД и РН. Также авторами подчеркнута необходимость проведения дальнейшей работы, направленной на более полное выявление роли и времени действия многих этих факторов при БЛД и РН. Наконец, по мнению авторов, обоснование которого не представлено в настоящем обзоре, проведению текущих исследований БЛД и РН на биологических моделях у животных и человека мешает отсутствие консенсуса в отношении понимания оптимальной биологической модели, включая анализ воздействия кислорода, а также отсутствие модели одновременного развития обоих заболеваний. Кроме того, не достигнуто соглашение в отношении наилучшего клинического определения обоих заболеваний [119-121]. К сожалению, результаты многих исследований трудно сравнивать или использовать для экстраполирования информации, которую можно безопасно проверять в клинических условиях после преждевременных родов [11]. В данном обзоре приводятся обширные сведения о перекрывании данных о факторах, нарушающих регуляцию ангиогенеза при БЛД и РН. Исходя из этого авторы выдвинули предположение о том, что подходы к исследованиям, разработанные так, чтобы предоставить возможность одновременного изучения возможных общих патогенетических механизмов, вероятно, прольют новый свет на оба заболевания и приведут к созданию более цельного подхода в отношении профилактики или лечения этих тяжелых осложнений недоношенности.
Вклад авторов. М.В. Волпе внесла в работу равный с Х.Ц. Нильсен вклад; она участвовала в разработке темы исследования, помогала и консультировала Э. Старка в изучении и критическом отборе литературы, подготовке и написании статьи. Э. Старк изучил и предоставил значительный объем просмотренного материала и помогал в принятии решении о включении данных и информации в статью, а также сыграл значительную роль в подготовке и переработке текста статьи. К. Дамманн помогала в подготовке, написании и переработке текста статьи и предоставляла идеи относительно тем для включения в данный обзор. Х.Ц. Нильсен наравне с М.В. Волпе внес значительный вклад в критический разбор литературы, планируемой для включения в данный обзор, а также в руководстве подготовкой и написания текста статьи.
Конфликт интересов. Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть расценены как потенциальный конфликт интересов.
Цель настоящего исследования - оценка значимости оперированной матки в рисках near miss при ее разрыве.
Материал и методы. Проведено ретроспективное многоцентровое когортное исследование в 27 учреждениях здравоохранения мегаполиса России с 1 января 2013 г. по 31 декабря 2018 г.
Результаты. Относительный риск (ОР) near miss при оперированной матке по сравнению с потенциально критическим акушерским состоянием (ПКАС) был незначим: ОР=0,95 [95% доверительный интервал (ДИ) 0,34-2,65]. При разрыве матки и рубца на ней относительный риск near miss в сравнении с ПКАС также был незначим: ОР=0,78 (95% ДИ 0,24-2,51). Установлена обратная корреляционная связь между толщиной нижнего сегмента матки в области рубца и объемом кровопотери (r=-0,58, p<0,05). При наличии рубца на матке и ее разрыве пациенток с near miss отличают более высокие показатели (p<0,05) числа беременностей, родов, срока беременности при 1-й явке в женскую консультацию, длительности первого периода родов или кесарева сечения, кровопотери, менее высокие показатели (p<0,05) срока беременности при родоразрешении, массы новорожденного и балльной оценке его состояния по шкале Апгар на 1-й и на 5-й минутах.
Заключение. Отсутствие рубца на матке после перенесенных на ней операций не исключает изменений структуры миометрия, предрасполагающих к разрыву при неадекватной нагрузке (беременности, родах). Рубец на матке не является обязательным условием для развития near miss при ее разрыве, но он ассоциирован с увеличением частоты разрыва матки при беременности, полного разрыва матки, необходимости перевязки ветвей восходящей маточной и/или внутренних подвздошных артерий, антенатальной гибели плода. Вероятность тяжелых осложнений для матери и новорожденного при разрыве матки представляет неисчерпаемый ресурс для поиска мер профилактики заболеваний или вмешательств, повышающих риск разрыва миометрия при беременности, родах и в послеродовом периоде, развития ПКАС или near miss.
Ключевые слова:оперированная матка, рубец на матке, разрыв матки, кесарево сечение, near miss, потенциально угрожающие жизни состояния, критические акушерские состояния
Операции на матке с последующим формированием рубца - фактор риска ее разрыва. Самой изученной причиной формирования рубца на матке признано кесарево сечение (КС) [1-3]. Разрыв матки остается причиной тяжелой материнской заболеваемости во всем мире [4], потенциально угрожающим жизни состоянием [5]. В последние годы тенденции родоразрешения женщин с оперированной маткой меняются [6-8], однако проблема родоразрешения при наличии рубца на матке остается поводом для острых дебатов [9, 10]. Неполноценность рубца на матке может быть причиной ее последующего разрыва не только в родах, но и при беременности [11], потребовать хирургической реконструкции рубца на матке во время беременности [12], при КС [13], после родоразрешения [14], вне беременности [15-17].
Возможности доклинической диагностики наличия и состояния рубца на матке крайне ограничены. Современные методы неинвазивной диагностики (ультразвуковое исследование, магнитно-резонансная и компьютерная томография) не гарантируют безукоризненную точность. Сохраняются разногласия о толщине нижнего сегмента матки, угрожаемой по разрыву, которая, по одним данным, может находится в диапазоне от 2,0 до 3,5 мм [18], по другим -<3,65 мм [19] и <3 мм [7]. В рандомизированном исследовании PRISMA [20] в соответствии с толщиной нижнего маточного сегмента классифицированы 3 категории риска разрыва матки: высокий (<2,0 мм), промежуточный (2,0-2,5 мм) и низкий (>2,5 мм).
Разрыв матки относится к потенциально угрожающим жизни материнским осложнениям [5], является причиной кровотечения, приводящего к шоку или требующего гистерэктомии, и может обусловить состояние near miss, редко - материнской смертности [21]. До настоящего времени сохраняет актуальность поиск мер по своевременному предотвращению или диагностике разрыва матки, в том числе при оперированной матке, минимизирующих последующие тяжелые осложнения и неблагоприятные исходы для матери и плода.
Цель настоящего исследования - оценка значимости оперированной матки в рисках near miss при ее разрыве.
Материал и методы
Проведено ретроспективное многоцентровое когортное исследование в 27 учреждениях здравоохранения мегаполиса России с 1 января 2013 г. по 31 декабря 2018 г. Анализ данных проводили с учетом того, была ли ранее оперирована матка, предполагалось ли наличие на матке рубца, к чему относился сход разрыва матки для матери - к потенциально критическим акушерским состояниям (ПКАС) или к near miss [21] (рис. 1). Критерии ПКАС (potentially life threatening condition) и near miss соответствовали рекомендациям Всемирной организации здравоохранения [5, 21].
Результаты исследования анализировали с помощью статистических программ Statistica 12.0, пакета анализа данных программы Microsoft Excel 2007. Оценивали показатели вариационного ряда: среднее значение (M), стандартное отклонение (SD), медиана (Me), 25-й и 75-й квартили (Q25 и Q75), минимальные и максимальные значения (min и max). Достоверность различий (р) при нормальном распределении признаков оценивали по t-критерию Стьюдента, при ненормальном распределении - по U-критерию Манна-Уитни. Коэффициент линейной корреляции Пирсона (r) оценивали с учетом нормальности распределения показателей.
Результаты
123 (79,9%) женщины исследуемых групп имели в анамнезе операции на матке (рис. 2). У трети женщин в анамнезе были операции, не предполагающие формирование рубца: выскабливание матки, раздельное диагностическое (РДВ) или после самопроизвольного выкидыша (СВ), артифициальный аборт (АА), либо сведения об оперативных вмешательствах на матке отсутствовали. У 103 (66,9%) женщин обеих групп предполагалось наличие рубца на матке: после кесарева сечения (КС), миомэктомии (МЭ), перфорации матки (П) или их сочетания (рис. 2А). Доля женщин с рубцом на матке при ПКАС и near miss была сопоставима (67,16 и 63,16% соответственно, р=0,65) (рис. 2Б). Доля женщин с ПКАС при оперированной матке составила 87,8% (n=108), при неоперированной - 87,1% (n=27); доля near miss при оперированной матке - у 12,2% (n=15), при неоперированной - 12,9% (n=4). Относительный риск (ОР) near miss при оперированной матке в сравнении с ПКАС не был значим: ОР = 0,95 [95% доверительный интервал (ДИ) 0,34-2,65].
Доля женщин без рубца на матке при ПКАС составила 32,59% (n=44) и при near miss 36,84% (n=7). ОР near miss при разрыве матки с рубцом в сравнении с ПКАС оказался не значим: ОР=0,78 (95% ДИ 0,24-2,51).
Установлены общеклинические особенности женщин с ПКАС и near miss при наличии рубца на матке или при его отсутствии (табл. 1).
Отметим, что толщина нижнего маточного сегмента в проекции рубца на матке перед родоразрешением варьировала от 0,5 мм и до <3,6 мм, при ПКАС составляла 2,0±0,84 мм (Me=2,0 мм, Q25-Q75=1,3-2,5 мм), при near miss -<0,6 мм (р=0,0007). Установлена значимая обратная корреляционная связь между толщиной нижнего сегмента матки в области рубца и объемом кровопотери (r=-0,58, p<0,05).
У женщин с рубцом на матке, перенесших near miss, были характерны более высокие показатели числа беременностей (р=0,004), родов (р=0,002), срока беременности при 1-й явке в женскую консультацию (р=0,03), длительности первого периода родов (р=0,004) или КС (р=0,00001), кровопотери (р=0,0000); менее высокие показатели срока беременности при родоразрешении (р=0,008), массы новорожденного (р=0,02) и балльной оценке его состояния по шкале Апгар на 1-й (р=0,000002) и 5-й минутах (р=0,000002) (см. табл. 1). Аналогично отличия женщин с near miss при отсутствии рубца на матке заключались в более высоких показателях срока беременности при 1-й явке в женскую консультацию (р=0,008) и кровопотери (р=0,018), а также большим диаметром маточного зева при интранатальной диагностике разрыва матки (р=0,005).
Особенности родоразрешения при ПКАС или near miss зависели не только от наличия рубца на матке либо его отсутствия, но и от вероятных причин его формирования. При ПКАС или near miss такие показатели, как, например, срок беременности при первых ультразвуковых признаках несостоятельности рубца на матке, при родоразрешении и объем кровопотери (рис. 3), значительно отличались в зависимости от перенесенных ранее оперативных вмешательствах на матке.
При сравнении особенностей осложнений родоразрешения при наличии рубца на матке (табл. 2) установлено, что для near miss характерны разрыв матки до родов (при беременности) (р=0,002), ее полный разрыв (p=0,0001), необходимость перевязки внутренних подвздошных артерий с двух сторон (p=0,03), внутренних подвздошных артерий с двух сторон и восходящей ветви маточных артерий (p=0,04), большая частота антенатальной гибели плода (p=0,0001).
При отсутствии рубца на матке женщин с near miss отличала от ПКАС, помимо преимущественного разрыва матки при беременности (р=0,03), ее полного разрыва (p=0,04) и необходимости перевязки восходящих ветвей маточных артерий (р=0,02), необходимость экстирпации матки с придатками с одной стороны (р=0,01).
В настоящем исследовании не получено убедительных данных о том, что оперированная матка и наличие рубца на ней повышают риски near miss вследствие ее разрыва, что может объясняться фиброзно-измененным миометрием и отсутствием васкуляризации в области рубца. Показано, что кровопотеря значительно выше при отсутствии рубца на матке, а не при его наличии, для женщин обеих групп (2084,72±1443,45 и 1421,9±1156,07 мл соответственно, р=0,007). Значимость отличий обусловлена за счет женщин с ПКАС, у которых кровопотеря оказалась значительно выше при отсутствии рубца на матке, чем при его на личии (1835,0±1369,19 и 1090,8±692,71 мл соответственно, р=0,0002), но не с near miss, у которых кровопотеря при наличии рубца на матке и его отсутствии была сопоставима (3333,33±1211,06 и 3850,0±961,53 мл соответственно, р=0,34). Геморрагический шок I-III степени диагностирован у женщин как с рубцом на матке, так и без него. Однако геморрагический шок IV степени перенесли женщины только с рубцом на матке - 8,33% (рис. 4).
Несмотря на то что кровопотеря при разрыве матки могла достигать 6000 мл (рис. 5), своевременные кровосберегающие технологии и хирургический гемостаз предотвратили развитие near miss при разрывах матки.
Заключение
Отсутствие рубца на матке после перенесенных на ней операций (выскабливание, АА) не исключает изменений структуры миометрия, предрасполагающих к разрыву при неадекватной нагрузке (беременности, родах). Однако оперированная матка не означает увеличение риска near miss в сравнении с ПКАС: ОР=0,95 (95% ДИ 0,34-2,65).
Разрыв матки с рубцом не является обязательным условием для развития near miss (ОР=0,78, 95% ДИ 0,24-2,51). Тем не менее у женщин, перенесших near miss, в отличие от ПКАС, рубец на матке ассоциирован с увеличением частоты разрыва матки при беременности, полного разрыва матки, необходимости перевязки ветвей восходящей маточной и/или внутренних подвздошных артерий, антенатальной гибели плода; у женщин с оперированной маткой при отсутствии рубца - с необходимостью перевязки восходящих ветвей маточных артерий (р=0,02), экстирпации матки с придатками с одной стороны (р=0,01).
Разрыв оперированной матки у женщин с ПКАС при отсутствии рубца сопряжен с большей кровопотерей, чем при его наличии (1835,0±1369,19 и 1090,8±692,71 мл соответственно, р=0,0002), у женщин с near miss - нет (3333,33±1211,06 и 3850,0±961,53 мл соответственно, р=0,34). Разрыв матки сопровождался геморрагическим шоком I степени у 2%, II степени у 7,8%, III степени у 2%, IV степени у 0,7% женщин анализируемых групп и у 0,7% женщин потребовал гистерэктомии по причине акушерского кровотечения. Однако геморрагический шок IV степени развился только у 8,33% женщин с рубцом на матке. Своевременные кровосберегающие технологии и хирургический гемостаз оказались высокоэффективным ресурсом профилактики near miss при разрыве матки, несмотря на возможную кровопотерю 6000 мл.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Всемирный день психического здоровья ежегодно отмечается 10 октября. В этом году его тема — предотвращение самоубийств. Мы перевели для вас обращение по теме этого года Марка Роуланда (Mark Rowland), директора Фонда психического здоровья (Mental Health Foundation) из Британии.
* * *
Наше послание (послание директора Фонда психического здоровья, Британия — прим. перев.) о профилактике самоубийств во Всемирный день психического здоровья — о надежде. Надежда — это кислород для нашего психического здоровья, жизненно важный ингредиент, помогающий держаться за жизнь.
Мы не можем отрицать реальность того, что самоубийство — разрушительная и мучительная трагедия. Она оканчивает одни жизни и разрушает бесчисленное множество других. В самоубийстве нет ничего романтичного или успокаивающего. Я знаю, потому что тоже прошёл через это. Я видел это собственными глазами.
Однако по мере того, как мы пытаемся понять суицид и объяснить его причины, нам также необходим срочный и последовательный подход для его предотвращения.
Хорошая новость заключается в том, что каждый шаг, который мы делаем для предотвращения самоубийств, также является шагом на пути к более психически здоровому обществу. Мы все выиграем, если создадим общество, где мы можем обращаться за помощью, избегать травм и страданий, и где можем получить поддержку, когда она нам понадобится.
Известно, что в 2018 году увеличилось количество самоубийств. Мы должны беспокоиться, особенно за молодёжь и мужчин. Мы пока не знаем причин. <…>.
Почему происходит самоубийство?
Причины самоубийств сложны. Большему риску люди подвергаются, когда объединяются множество факторов. В основном, это финансовая неопределённость, нищета, безработица, травматические события в жизни и сохраняющееся неравенство, все эти факторы оказывают значительное влияние наряду с другими причинами, включая плохое здоровье, одиночество и дискриминацию.
Работа профессора Рори О’Коннер (Rory O’Conner) показывает, что чувство поражения или попадания в ловушку является распространённым предвестником самоубийства. Вот почему так важно говорить о надежде.
Что можно сделать с обществом, чтобы предотвратить самоубийства?
Две трети покончивших с собой не имели доступа к психиатрической помощи, поэтому необходимо охватить ею гораздо больше людей, чем сейчас, чтобы она была действительно эффективной. Вот четыре важных шага:
- Больше внимания от окружающего общества и больше медицинской поддержки людям, подверженным повышенному риску (вышедшие из больницы, ветераны и лица, пережившие насилие). Это также относится к семьям погибших, потому что мы знаем, что потеря близкого от самоубийства увеличивает риск самоубийства. Подобная поддержка отсутствовала в моём опыте, связанном с самоубийством.
- Ограничение доступа к средствам самоубийства имеет жизненно важно. Местные органы власти и правительство играют жизненно важную роль в рамках планов по предотвращению самоубийств на местах, принимая практические меры по обеспечению безопасности граждан. Установка сетей под мостом Золотые ворота в Сан-Франциско — один из примеров.
- Обучение детей эмоциональной грамотности. Мы знаем, что это имеет долгосрочные преимущества для психического здоровья и благополучия. Кампания нашего фонда «Пусть с тобой считаются» призывает поставить психическое здоровье во главу угла того, чему дети учатся в школе, призывает к пониманию того, что оно является жизненно важной частью в расширении возможностей детей управлять своими эмоциями здоровым образом и повышать устойчивость к стрессу.
- Наконец, одним из ключевых инструментов является то, что мы говорим. Например, в Австралии за последние 25 лет вложили значительные средства в такие высокоэффективные подходы, как «Состояние ума» (Mind Frame). В соответствии с этим подходом на СМИ возлагается ответственность за правильное освещение самоубийств. По мере повышения осведомлённости важно не делать самоубийство гламурным и не изображать как обыденное явление.
Каждый может изменить к лучшему ситуацию для людей, достигших той точки, когда они захотели покончить с собой. Во Всемирный день психического здоровья у нас есть возможность узнать о реальности суицида и о том, как дать надежду тем, кто, вероятно, находится в критической ситуации.
Что я могу сделать в день психического здоровья?
Повысить осведомлённость с помощью зелёной ленты. Вы можете присоединиться к движению по повышению знаний о профилактике самоубийств, надев зелёную ленту, международный символ осведомлённости о психическом здоровье. Вы также можете поделиться им в виде цифрового стикера, доступного на большинстве платформ социальных сетей, просто наберите в поиске green ribbon. Покажите коллегам, близким или просто знакомым, что вы заботитесь об их психическом здоровье. Зелёную ленту также можно носить в память о близком человеке. Я, например, ношу зелёный значок в память о старшем брате и поддержку всех тех, кто потерял близкого человека в результате самоубийства.
Принимайте меры. Четыре простых действия с вашей стороны помогут поддержать другого человека, склонного к самоубийству.
- Наблюдайте за признаками стресса и нехарактерным поведением. Например, чрезмерная молчаливость, раздражительность, нетипичный всплеск эмоций, разговоры о смерти или самоубийстве.
- Задайте прямой вопрос: «Есть ли у тебя мысли о самоубийстве?» Вопрос о самоубийстве не подталкивает к нему и не побуждает человека задуматься над ним. Но может предотвратить его и стать началом разговора, спасшего жизнь.
- Объясните, что это пройдёт, дайте надежду и заверьте близкого человека, что, если обратиться за помощью, суицидальные чувства пройдут со временем.
- Поговорите с окружающими, чтобы они попросили вашего близкого обратиться за помощью к психотерапевту или врачу-специалисту.
Каждый может помочь в профилактике самоубийств в школах, на рабочих местах, в семьях. Чем бы вы ни занимались, примите в этом активное участие.
Во Всемирный день психического здоровья мы сочувствуем всем, кто пострадал от самоубийств и всем, кто испытывает суицидальные чувства. Мы хотим, чтобы вы знали, что нам не всё равно и вы не одиноки.
Посттравматическое стрессовое расстройство (ПТСР) — один из наиболее распространённых ментальных недугов. Несмотря на это, до сих пор было неясно, почему посттравматический стрессовый синдром развивается не у всех, кто пережил травматическое событие. Некоторые исследователи предполагают, что данное расстройство вызвано социальными факторами, но исследования могут показать, что генетические факторы также играют определённую роль.
В самом крупном на сегодняшний день исследовании генетических оснований ПТСР, проведённом учёными из Медицинской школы в Сан-Диего при Калифорнийском университете (University of California, San Diego, School of Medicine) в более чем 130 учреждениях, участвующих в Консорциуме психиатрической геномики (Psychiatric Genomics Consortium), обнаружили, что ПТСР имеет сильный генетический компонент, аналогичный тому, что присутствует в других ментальных расстройствах. Генетика, пишут они в Nature Communications, составляет от 5 до 20 % риска ПТСР после травматического события.
«Наша долгосрочная цель заключается в разработке инструментов, способных помочь врачам предсказать, кто подвергается наибольшему риску ПТСР и персонализировать подходы к лечению, — говорит ведущий автор исследования Кэролайн Нивергельт (Caroline Nievergelt), доктор медицинских наук. — Мы не всегда можем защитить людей от травм, но можем лечить их эффективнее и в более сжатые сроки».
Исследовательская группа также сообщает, что, как и другие ментальные расстройства и другие черты человека, ПТСР, является высокополигенным. Это означает, что заболевание связано с тысячами генетических вариантов в геноме, вносящих небольшой вклад в развитие данного расстройства. Шесть геномных регионов под названием «варианты скрытых локусов», тесно связаны с риском заболевания, это даёт некоторое представление о биологических путях развития ПТСР.
«Основываясь на этих открытиях можно сказать, что в риске ПТСР существует не меньшая генетическая составляющая, чем в клинической депрессии и других ментальных расстройствах, — говорит автор исследования Карестан Коэнен (Karestan Koenen), доцент Психиатрического центра Стенли при Институте Броада (Stanley Center for Psychiatric Research at Broad Institute). — Наша ограниченная способность изучать живой мозг и выявлять корни посттравматического расстройства — причина отсутствия лечения и стигматизации в связи с этой изнурительной болезнью. Генетика помогает нам делать открытия, находить возможности для новых методов лечения и бороться со стигматизацией».
Для проведения исследования Коэнен, Нивергельт и их коллеги сотрудничали с рабочей группой Консорциума психиатрической геномики по ПТСР и некоммерческой организацией Cohen Veterans Bioscience, занимающейся поддержкой исследований ПТСР и травматических повреждений головного мозга. Вместе они создали сеть из более чем 200 исследователей в 12 странах, собрав данные и образцы ДНК у более чем 60 групп людей с ПТСР и у контрольных групп, включая Британский биобанк (UK Biobank).
Группа, в совокупности насчитывающая более 200 000 человек, что в 10 раз больше, чем в первом исследовании ПТСР, опубликованном в 2017 году Консорциумом психиатрической геномики, включала как гражданских лиц, так и военнослужащих. На сегодняшний день данная когорта также является наиболее разнообразной с точки зрения родословной среди исследований в области психиатрической генетики. Среди исследуемых более 23000 человек с ПТСР имеют европейское происхождение и более 4000 — африканское.
Исследователи использовали данные для проведения общегеномного исследования (GWAS), используя статистические тесты для измерения влияния общих генетических вариантов в миллионах точек генома на вероятность развития ПТСР у человека.
В ходе анализа были выявлены варианты ДНК в шести локусах, тесно связанных с риском ПТСР. Три из шести локусов были характерны для определённых предков — два европейских и один африканский, три из них были обнаружены исключительно у мужчин. Шесть локусов указывают на то, что в расстройстве могут быть задействованы воспалительные и иммунные механизмы, что согласуется с результатами предыдущих исследований.
По всему геному значительное число вариантов в той или иной степени ассоциировалось с ПТСР, что свидетельствует о высокой полигенности данного расстройства. Исследователи пришли к выводу, что наследственность ПТСР, то есть уровень влияния генетики на изменчивость риска ПТСР в популяции, составляет от 5 до 20 %, с некоторыми колебаниями в зависимости от пола. Подобные выводы были сделаны в отношении различных групп предков.
Поскольку многие поведенческие черты и ментальные расстройства имеют общую генетическую основу, учёные исследовали генетическую корреляцию между ПТСР и другими расстройствами, поведением и физическими особенностями. Они обнаружили значительное совпадение с 21 заболеванием, включая шизофрению, невротичность, бессонницу, астму и заболевание коронарной артерии.
В качестве первого шага на пути к поиску путей прогнозирования развития ПТСР, исследовательская группа использовала данные Британского биобанка для разработки полигенной оценки, способной предсказать риск развития ПТСР. Баллы полигенности учитывают влияние миллионов генетических вариаций для предсказания вероятности, что человек проявит некую черту или будет иметь расстройство.
Группа протестировала свои оценки на данных о мужчинах из Британского биобанка, и выяснила, что шансы на развитие у тех, кто набрал большее количество баллов, в 0,4 раза выше, чем у тех, кто набрал наименьшее количество баллов.
Аналогичным образом, когда учёные применили оценку в отношении данных Million Veterans Program, в рамках которой изучается влияние генов, образа жизни и воздействия войны на здоровье и возникновение болезней, те, кто набрал наибольшее количество баллов, значительно чаще переживали травматические воспоминания — ключевой симптом ПТСР.
Авторы исследования подчеркнули, что баллы полигенности ещё не готовы к клиническому использованию. Для повышения точности прогнозирования посттравматических стрессовых расстройств необходимы ещё более масштабные исследования с использованием более разнообразных наборов данных.
Международная команда ученых оценила сколько людей в мире болеют и умирают от рака, каково число лет жизни прожитых больными с онкологией или потерянных вследствие преждевременной смерти, какие из видов рака наиболее распространены, а какие уносят наибольшее число жизней, и насколько рак сопоставим с другими болезнями.
Международная команда ученых Global Burden of Disease Cancer Collaboration из 195 стран оценила бремя от онкологических заболеваний. Сколько людей в мире болеют, а сколько — умирают от рака, каково число лет жизни, прожитых больными с онкологией или потерянных вследствие преждевременной смерти, какие из видов рака наиболее распространены, а какие уносят наибольшее число жизней, и насколько подобное бремя сопоставимо с другими болезнями.
Результаты исследования опубликованы в журнале JAMA Oncology.
Работа проведена под руководством доктора Кристины Фицморис и профессора Кристофера Мюррея. От России в исследовании принимали участие ученые из Московского физико-технического института, а также из ВШЭ, МГТУ и Первого меда.
Результаты проведенного систематического исследования показали, что в 2017 году раком заболели 24,5 миллиона человек (16,8 миллионов без учета немеланомного рака кожи) и 9,6 миллионов — скончались от онкологических заболеваний. За период с 2007 по 2017 год число случаев онкологических заболеваний возросло на 33 процента (при этом наименьший прирост наблюдался в экономически развитых странах).
«Рост онкологических заболеваний – закономерный результат прогресса в медицине. Мы научились лечить или предупреждать множество инфекционных заболеваний. Ожидаемая продолжительность жизни существенно возросла, как и взаимное влияние человека и окружающей среды.
Но люди остаются смертными, и на ведущее место среди причин смерти выходят онкологические заболевания», — говорит участник команды исследователей Станислав Отставнов, заместитель заведующего лабораторией анализа показателей здоровья населения и цифровизации здравоохранения МФТИ (Цифромед Физтеха).
Для определения социально-экономического бремени рака ученые рассчитали показатель DALY (от английского disability-adjusted life years), это сумма лет жизни, прожитых с нетрудоспособностью YLD (от английского years lost due to disability), и потерянных лет жизни, недожитых до среднего возраста смерти YLL (от английского years of life lost). DALY от онкозаболеваний в 2017 году было оценено в 233,5 миллиона лет, из которых примерно 225 миллионов лет приходится на потерянные годы жизни (YLL).
Если в 2007 году тройка лидеров по DALY выглядела следующим образом: респираторные заболевания и туберкулез, материнские и неонатальные расстройства, сердечно-сосудистые заболевания — а онкологические заболевания занимали лишь шестое ранговое место, то спустя 10 лет ситуация существенно изменилась: на первое место вышли сердечно-сосудистые заболевания, на второе — онкологические.
Наиболее распространенными в мире группами онкологических заболеваний являются немеланомный рак кожи, рак трахеи, бронхов и легких, онкопатология груди, рак толстой и прямой кишки и рак простаты.
В России на первом месте по распространенности находится немеланомный рак кожи, второе и третье место делят рак толстой и прямой кишки и онкопатология груди, далее идут рак трахеи, бронхов и легких, а также рак желудка.
Наибольшее число жизней как в мире, так и в России, уносят рак трахеи, бронхов и легких, рак толстой и прямой кишки и онкопатология желудка. В то же время в России, как и во всей Восточной Европе, рак печени распространен меньше, чем в среднем по миру.
Станислав Отставнов добавляет: «Сейчас 51 процент от заболеваемости раком приходится на страны с высоким социально-демографическим индексом (интегральным показателем, включающим в себя оценку уровня доходов, уровня образования и коэффициента рождаемости). При этом лишь 30 процентов от случаев смерти от рака и 24 процента — от значения DALY».
За период с 2007 по 2017 годы стандартизированный по возрасту показатель заболеваемости раком вырос для большинства стран мира (в России, а также в США, Канаде и Финляндии он находится в пределах от 0,1 до 1 процента).
В то же время среднегодовые стандартизированные по возрасту показатели смертности для всех видов рака в совокупности снизились в большинстве исследованных стран, в том числе и в России (в пределах 1–2 процентов, как Канаде, Японии, Франции и Португалии).
«Рак и другие неинфекционные заболевания в настоящее время широко признаны как угроза глобальному развитию, профилактика и борьба с ними — одна из приоритетных задач, признаваемых ООН. Однако на пути к этой цели существует ряд препятствий, таких как отсутствие прозрачных механизмов расстановки приоритетов и ограниченность бюджета.
Без детального понимания эпидемиологической обстановки невозможно принимать адекватные решения. Источником же информации для этого могут послужить исследования, проводимые Global Burden of Disease Collaboration», — говорит участник команды исследователей Станислав Отставнов.
Ожирение — гетерогенная группа наследственных и приобретенных заболеваний, связанных с избыточным накоплением жировой ткани в организме. В настоящее время ожирение — причина около 5 % смертей во всем мире. Если скорость распространения этого заболевания останется прежней, к 2030 году почти половина взрослого населения мира будет иметь избыточный вес или ожирение [1]. Избыточный вес и ожирение давно перестали быть проблемами взрослого населения и распространились на детскую популяцию. По оценкам ВОЗ, в 2016 году около 41 миллиона детей в возрасте до 5 лет имели избыточный вес или ожирение. В США за последние 30 лет количество детей, страдающих ожирением, увеличилось на 17 % (12,7 миллиона человек в возрасте от 2 до 19 лет были зарегистрированы как тучные) [2]. Несмотря на сохраняющиеся высокие уровни недоедания в странах со средним уровням развития и развивающихся странах, на их территории также отмечается увеличение числа детей, страдающих избыточным весом и ожирением. В Африке с 2000 года число детей в возрасте до 5 лет, страдающих ожирением, выросло почти на 50 %. В 2016 году почти половина детей в возрасте до 5 лет с избыточным весом или ожирением проживала в Азии.
В подростковой группе проблема избыточной массы тела и ожирения также набирает обороты. Распространенность избыточного веса и ожирения среди подростков в возрасте до 19 лет резко возросла и превысила 18 % в 2016 году. Эти цифры равномерно распределены среди детей и подростков обоих полов: в 2016 году избыточным весом страдали 18 % девочек и 19 % мальчиков. Таким образом, ожирение является одной из глобальных социальных проблем наряду с курением и вооруженным насилием. В целом, в мире от последствий избыточного веса и ожирения умирает больше людей, чем от последствий аномально низкой массы тела. Число людей с ожирением превышает число людей с пониженной массой тела; такое положение дел наблюдается во всех регионах, кроме некоторых районов Африки к югу от Сахары и Азии.
Ожирение представляет собой хроническое мультифакторное заболевание с тяжелыми краткосрочными и долгосрочными последствиями. Избыточный вес в раннем детстве имеет тенденцию сохраняться в течение многих лет. Так, Guo et al. обнаружили, что вероятность ожирения в возрасте 35 лет доходит до 80 % у лиц, у которых ожирение наблюдалось в детстве [3].
Опасность распространения ожирения в детской популяции в том, что заболевания, которые обычно считаются заболеваниями взрослых, все чаще поражают детей и подростков с избытком массы тела. Сопутствующие ожирению заболевания влияют на сердечно-сосудистую, эндокринную, легочную и пищеварительную системы, а также оказывают негативное влияние на психическое состояние ребенка. Гипертония — классическая проблема взрослых — считалась редким заболеванием у детей, и являлась в основном вторичной по отношению к почечным, эндокринным или сердечно-сосудистым заболеваниям, таким как коарктация аорты. Тем не менее в настоящее время первичная гипертония становится все более распространенным заболеванием в детстве. Различные исследования показали, что увеличение веса связано с повышением артериального давления, а распространенность артериальной гипертензии намного выше у тучных детей [4].
У здоровых детей ожирение является хорошо известным фактором риска развития метаболического синдрома, диабета II типа и сердечно-сосудистых заболеваний в будущем. Гораздо меньше известно о сердечно-сосудистых последствиях ожирения у детей с врожденными и приобретенными пороками сердца. Учитывая наличие структурных перестроек, связанных с ВПС и перенесенным кардиохирургическим вмешательством, ожирение может быть одним из немногих модифицируемых факторов, который может предотвратить будущие сердечно-сосудистые заболевания в этой популяции пациентов [5].
Влияние ожирения на сердечно-сосудистую систему связано с повышенными метаболическими потребностями из-за увеличения жировой ткани и мышечной массы, увеличения объема крови и, следовательно, возрастания преднагрузки на сердце. Исследования показали, что левое предсердие и левый желудочек (ЛЖ) значительно больше у детей с ожирением, по сравнению с детьми с нормальным ИМТ. В нескольких исследованиях также сообщалось о большей массе ЛЖ у детей с ожирением, при этом разница была обнаружена в возрасте 2 лет. Кроме того, у детей с избыточной массой тела также присутствовало большее количество эпикардиального жира, по сравнению с детьми со здоровым ИМТ [6]. Помимо органических изменений камер сердца, тяжелое ожирение у детей связано с повышенной жесткостью артериальной стенки и эндотелиальной дисфункцией. У подростков ожирение ассоциируется с увеличением толщины интимы сонной артерии (CIMT), что является маркером ишемической болезни сердца и фактором риска инфаркта миокарда и инсульта в зрелом возрасте [3].
Более выраженное негативное влияние ожирения на здоровье детей с врожденным пороком сердца (ВПС) объясняется имеющимися у таких пациентов аномалиями миокарда, на которые могут накладываться сердечно-сосудистые факторы риска. Избыточный вес и ожирение часто встречаются у детей, получающих лечение по поводу ВПС. Недавнее исследование, проведенное в клинике Кливленда, показало, что распространенность избыточного веса и ожирения у детей с ВПС составляла 31,5 % и 16,4 % соответственно. В исследовании не было контрольной группы, но эти показатели были сопоставимы с показателями, найденными в исследовании NHANES 2013–2014 гг. в общей педиатрической популяции. В дополнение исследователи смогли определить переходный период (возраст 6–10 лет), когда пациенты, ранее имеющие нормальный вес, переходили в группу с избыточным весом или ожирением.
Ожирение повлияло также на самую уязвимую группу пациентов детской кардиохирургии, которые страдают тяжелым пороком и имеют единственный желудочек сердца. Такие пациенты требуют паллиативного вмешательства — операции Фонтена. Ранее в исследованиях Pinto et al. сообщалось, что эта группа реже страдает ожирением, чем пациенты с бивентрикулярными ВПС. Тем не менее в исследовании Wellnitz et al. обнаружилось, что в течение 5 лет после операции Фонтена распространенность избыточного веса и ожирения возрастала — 10,7 % пациентов имели избыточный вес или страдали ожирением до вмешательства, 20,3 % соответствовали критериям через год после операции, а 30 % соответствовали критериям через 5 лет после операции. Это особенно важная проблема, так как ожирение может стать серьезным препятствием для нормальной работы единственного желудочка. В своем исследовании Martinez et al. сообщили о связи между ожирением и симптоматической сердечной недостаточностью у пациентов после проведения операции Фонтена [3].
Факторы риска развития ожирения у детей с ВПС
Дети с ВПС имеют как традиционные, так и некоторые уникальные факторы риска развития ожирения. Поперечное исследование подростков и молодых людей (в возрасте 15–39 лет) с ВПС выявило высокие показатели потребления насыщенных жиров, сопоставимые с количествами, обнаруженными у взрослых с повышенным уровнем холестерина и ЛПНП [7].
В дополнение к традиционным диетическим факторами риска в педиатрической популяции детей с ВПС существуют уникальные факторы, которые могут способствовать развитию ожирения. Пациенты со сложным ВПС часто имеют недостаточный вес в младенческом возрасте [8]. В результате детские кардиологи, педиатры и диетологи концентрируются на максимальном увеличении количества потребляемых калорий в раннем детстве. Многие новорожденные и даже дети младшего возраста переводятся на высококалорийные смеси.
Ограничение физических упражнений является еще одним уникальным фактором риска у детей с ВПС. Ограничение соревновательных видов спорта и физических упражнений обычно рекомендуется для определенных форм врожденных и приобретенных пороков сердца, таких как гипертрофическая кардиомиопатия, синдром удлиненного интервала QT, стеноз аорты средней и тяжелой степени и аномалии коронарных артерий, хотя даже для этих заболеваний рекомендации меняются [9]. Эти ограничения не распространяются на большинство детей и подростков с ВПС. Тем не менее некоторые врачи рекомендуют ненужное ограничение упражнений из-за прошлой практики и/или устаревшей литературы. Несмотря на принципы соревновательных видов спорта, нет никаких доказательств того, что ограничение физической активности предотвращает внезапную смерть в популяции.
Некоторые ненужные ограничения могут быть связаны с родительской тревогой относительно предполагаемого риска внезапной сердечной смерти. Большое исследование, выполненное Jortveit et al. (анализ норвежского регистра рождений), показал, что в популяции с более чем 11 000 детей с ГБ, родившихся с 1994 по 2009 год и наблюдавшихся до 2012 года, не было внезапных смертей, связанных с физической активностью. В конечном счете польза от физических упражнений перевешивает риски, и текущие исследования сосредоточены на продвижении физической активности.
Сердечно-сосудистые последствия у детей с ВПС и ожирением
У детей с ожирением и избыточной массой тела могут наличествовать структурные или функциональные нарушения, которые делают их более уязвимыми в контексте развития атеросклероза.
Пациенты с врожденными или приобретенными нарушениями коронарного кровотока имеют особенно высокий риск развития преждевременных сердечно-сосудистых заболеваний. Исследования пациентов после операции артериального переключения отмечают возникновение аномалий коронарных артерий, включая снижение вазореактивности коронарных артерий, уменьшение резерва коронарного кровотока и увеличение проксимальной пролиферации интимы (предшественник атеросклероза) [5]. Таким образом, ожирение создает дополнительную сердечно-сосудистую нагрузку для этой группы пациентов. Сообщалось также о других сердечно-сосудистых нарушениях у детей с ожирением, перенесших операцию артериального переключения, включая более высокие показатели дислипидемии и гипертонии, сниженную сосудистую реактивность и более высокую массу левого желудочка, по сравнению с детьми с нормальным весом, которые перенесли операцию артериального переключения
Пациенты с коарктацией аорты также попадают в категорию высокого риска. Они подвержены повышенному риску развития гипертонии и преждевременных сердечно-сосудистых заболеваний. В популяции этих пациентов нарушение кровотока, опосредованное вазодилатацией, и увеличение толщины интимы сонной артерии — ранние признаки эндотелиальной дисфункции — были отмечены уже в раннем детстве. Беспокойство вызывает тот факт, что распространенность избыточного веса/ожирения в популяции детей, перенесших оперативное вмешательство по поводу коарктации, чрезвычайно высока. Smith-Parish et al. обнаружили, что к 10 годам у 25 % пациентов, перенесших хирургическое лечение коарктации, был избыточный вес или ожирение; этот показатель вырос до 63 % к возрасту 20 лет [11]. Неясно, почему эти пациенты имеют такие высокие показатели избыточного веса и ожирения, этот факт требует дальнейших исследований.
В популяции пациентов с тетрадой Фалло больные с ожирением имели увеличенную бивентрикулярную массу на МРТ сердца, причем правая сторона поражалась сильнее, чем левая. Кроме того, у когорты пациентов с ожирением был уменьшен диастолический объем конечного бивентрикулярного и ударного объема сердца при индексации к площади поверхности тела. Долгосрочное влияние этих изменений неясно, но в такой популяции, где правое сердце уже увеличено за счет гипертрофии, эти изменения могут быть еще более опасными или могут привести к большему количеству повторных вмешательств в течение жизни пациента [5].
Таким образом, долгосрочные последствия эпидемии ожирения для детей с ВПС не совсем ясны и требуют дальнейшего изучения. Однако уже сейчас очевидны возможные осложнения у детей с ВПС. Поэтому детские кардиологи, педиатры и сердечно-сосудистые хирурги обязаны серьезно относиться к мониторингу своих пациентов и профилактике возникновения избыточной массы тела и ожирения.






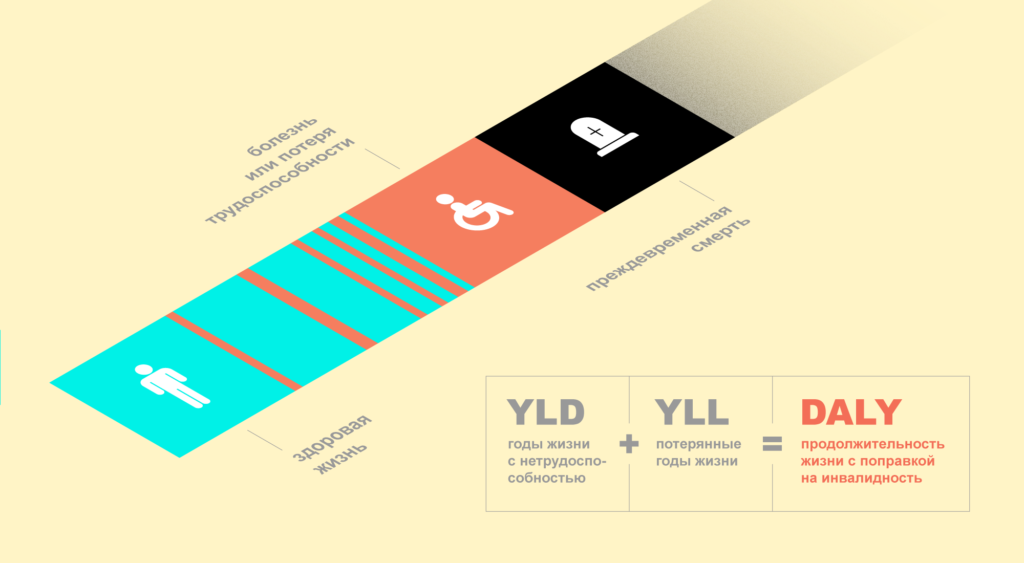 h
h


