Новости
Резюме
Бронхолегочная дисплазия (БЛД) - это хроническое полиэтиологическое заболевание морфологически и функционально незрелых легких, наиболее часто встречающееся у недоношенных новорожденных, которым требуется респираторная поддержка и оксигенотерапия для купирования острой дыхательной недостаточности. Самыми важными факторами риска данного заболевания являются агрессивные факторы респираторной терапии, оказывающие прямое повреждающее воздействие на структуры бронхолегочной системы.
Цель исследования - оценить роль факторов респираторной терапии в формировании БЛД у недоношенных новорожденных с очень низкой и экстремально низкой массой тела при рождении.
Материал и методы. В исследование были включены 97 недоношенных новорожденных со сроком гестации <32 нед, массой тела при рождении <1500 г, имеющие дыхательные нарушения и требующие проведения респираторной терапии. В зависимости от исхода респираторной патологии дети были разделены на 2 группы: 1-я группа - дети с БЛД (n=50), 2-я группа - дети, выздоровевшие от респираторной патологии (n=47).
Результаты и обсуждение. Установлено, что масочная и эндотрахеальная искусственная вентиляция легких в родовом зале увеличивает риск формирования БЛД. Детям 1-й группы по сравнению с детьми 2-й группы достоверно чаще требовалось проведение эндотрахеальной [64,0 и 31,9% соответственно, р=0,001; отношение рисков (ОР) 3,793 (доверительный интервал (ДИ) 1,633-8,806)] и масочной вентиляции [74,0 и 40,4% соответственно, р=0,001; 0Р=4,194 (ДИ 1,776-9,906)]. Установлено, что использование дополнительного кислорода на этапе родового зала значимо чаще отмечалось в 1-й группе новорожденных по сравнению с детьми из 2-й группы [96,0 и 44,7% соответственно, р=0,001; 0Р=29,71 (ДИ 6,455-136,8)]. Схема пролонгированной респираторной терапии, включающая эндотрахеальную или неинвазивную вентиляцию и кислородотерапию потребовалась в 56,0% случаев в 1-й группе пациентов и в 25,5% случаев во 2-й группе детей [р=0,002; 0Р=3,712 (ДИ 1,546-8,783)]. Максимальное значение среднего давления в дыхательных путях, экспираторного дыхательного объема, фракции кислорода и суммарная длительность их воздействия достоверно выше были в 1-й группе по сравнению со 2-й (р=0,001). Использование несинхронизированных алгоритмов эндотрахеальной респираторной поддержки достоверно чаще регистрировалось у новорожденных 1-й группы по сравнению с детьми из 2-й группы [42,1 и 14,3% соответственно, р=0,026; 0Р=4,367 (ДИ 1,096-17,370)].
Выводы. Агрессивными факторами респираторной терапии, способствующими формированию БЛД у новорожденных с очень низкой и экстремально низкой массой тела при рождении являются эндотрахеальная и масочная вентиляция легких на этапе родового зала, длительное использование эндотрахеальной вентиляции легких в комплексе с неинвазивной вентиляцией и кислородотерапией, высокие значения среднего давления в дыхательных путях, экспираторного дыхательного объема и фракции кислорода, применение несинхронизированных алгоритмов эндотрахеальной респираторной поддержки.
Ключевые слова:бронхолегочная дисплазия, респираторная терапия, глубоконедоношенные новорожденные, экстремально низкая масса тела, очень низкая масса тела, отделение реанимации и интенсивной терапии новорожденных
Успехи, достигнутые в области интенсивной терапии дыхательных нарушений в последние годы, способствуют значительному снижению неонатальной смертности новорожденных с массой тела при рождении <1500 г. Наряду с этим все большую актуальность стали приобретать осложнения респираторной патологии и интенсивной терапии дыхательных нарушений, среди которых одна из ведущих позиций принадлежит бронхолегочной дисплазии (БЛД). Частота ее возникновения у данной категории детей может достигать 50,0% [1, 2].
В связи с неуклонным ростом числа преждевременных родов, увеличением случаев рождения детей с очень низкой (ОНМТ) и экстремально низкой массой тела (ЭНМТ) и существенным пересмотром взглядов о механизмах развития, диагностике и терапии дыхательных нарушений в неонатальном периоде наибольшую актуальность приобретает необходимость подтверждения ранее известных и поиск новых факторов риска формирования БЛД. Рассматривая БЛД в качестве мультифакторной патологии, особое значение приобретает оценка не только таких широкоизвестных факторов риска, как гестационный возраст, низкие антропометрические характеристики, тяжесть дыхательных нарушений, осложненное течение беременности и др., но и агрессивных средовых факторов, среди которых наибольшую значимость приобретают особенности респираторной терапии, оказывающие прямое повреждающее воздействие на структуры бронхолегочной системы новорожденного.
Вынужденное начало внешнего дыхания и газообмена в условиях морфофункциональной незрелости глубоконедоношенных новорожденных диктует необходимость полного или частичного замещения функции внешнего дыхания. Использование методов респираторной терапии, основанных на формировании и поддержании постоянного или переменного положительного давления в дыхательных путях, а также дополнительного кислорода во вдыхаемой смеси, способствует формированию вентилятор-индуцированных повреждений легких. Респираторная система недоношенного новорожденного особенно восприимчива к такого рода повреждениям ввиду выраженной склонности легочной ткани к ателектазированию, причиной которого являются первичный дефицит или качественные аномалии сурфактанта и снижение количества коллагена и эластина в проводящей части дыхательной системы. Таким образом, кроме положительного протекционного компонента, респираторная поддержка может оказывать и повреждающее воздействие как на пораженные, так и на неизмененные легкие. Избыточное давление в дыхательных путях, высокое значение дыхательного объема (гиперинфляция) и высокие концентрации кислорода во вдыхаемой смеси повреждают клетки дыхательного эпителия. Происходят экстравазация белковых молекул во внутреннее пространство альвеол, дисфункция сурфактанта и активация нейтрофилов. Запускается системная воспалительная реакция, активируются фагоциты и Т-лимфоциты (CD4+ и CD8+) [3]. Это приводит к стимуляции продукции провоспалительных цитокинов, которые участвуют в патогенезе практически всех патологических состояний, характерных для недоношенных детей, в том числе и БЛД [4]. Отмечаются значимое увеличение плазменной концентрации ИЛ-6 и ФНОα непосредственно после начала вентиляции, повышенная экспрессия хемокина и ИЛ-8 в легких, миграция нейтрофилов к очагам воспаления и прямое альтернирующее действие на эпителиальные клетки легочной ткани [5]. Повреждение легких при искусственной вентиляции легких (ИВЛ) не только увеличивает число активированных клеток воспаления и концентрацию медиаторов воспаления, но и способствует бактериальной инвазии, что может стать причиной вторичного септического процесса и дальнейшего повреждения дыхательной системы.
Режимы респираторной поддержки у новорожденных традиционно основаны на принципе вентиляции с управляемым давлением (Pressure Control Ventilation, PCV) [6]. В связи с этим наиболее агрессивным фактором ИВЛ, согласно результатам экспериментальных исследований, считалось среднее давление в дыхательных путях (МАР), высокие значения которого способствуют дисфункции альвеолярного эпителия, вторичной сурфактантной недостаточности [7]. Помимо этого, высокое значение МАР может стать причиной развития баротравмы и, как следствие, синдромов утечки воздуха (интерстициальная легочная эмфизема, пневмоторакс, пневмомедиастинум). Однако исследования, проведенные на животных, показали, что повреждения легких в большей степени ассоциированы с их перераздутием и соответственно с увеличением дыхательного объема [8], который зависит от биомеханических свойств бронхолегочной системы (податливость легких, сопротивляемость дыхательных путей, константа времени). Волюмотравма возникает в результате поступления в легкие как избыточного, так и недостаточного дыхательного объема. Возникающее при этом перерастяжение или склонность к развитию ателектазов способствует повреждению дыхательного эпителия, выработке цитокинов, в том числе ИЛ-6 и ИЛ-8, и развитию асептического воспаления, которое и становится основой для формирования БЛД [9]. Результаты исследования B.J. Stenson и соавт. (2006) указывают на то, что у новорожденных травма, вызванная объемом, может быть реализована после всего нескольких гиперинфляций или в течение короткого временного промежутка (до 30 мин) во время первичной респираторной стабилизации в родовом зале [10]. В связи с этим стратегия протективной вентиляции легких диктует необходимость использования мониторинга дыхательного объема (Vt) и уровня положительного давления в конце выдоха (РЕЕР) уже с первых минут жизни.
Наряду с повреждающим воздействием давления и объема на легкие новорожденного во время проведения респираторной поддержки рассматривается также токсическое воздействие высоких концентраций кислорода. Постнатальная гипероксия стимулирует образование свободных радикалов, которые подавляют функцию несовершенных антиоксидантных ферментных систем и вызывают повреждение легочной ткани. Кроме того, гипероксия значимо увеличивает экспрессию TGF-β1 [11], а также уровни провоспалительных цитокинов [12]. Оксидативный стресс способствует утяжелению общего состояния, дисбалансу центральной гемодинамики, поражению центральной нервной системы, увеличению количества "вентиляционных дней" и удлинению времени пребывания в отделении реанимации и интенсивной терапии новорожденных (ОРИТН) [13-15]. В обзоре G. Rocha (2008) сделан акцент на важной роли оксидативного стресса и свободных радикалов кислорода в нарушениях роста и развития клеток легочной ткани и соответственно в патогенезе БЛД [16].
Таким образом, агрессивные параметры респираторной терапии и длительность их суммарного воздействия на легочную ткань недоношенного новорожденного представляют собой значимые экзогенные, модифицируемые факторы риска формирования БЛД. Уточнение их роли в патогенезе хронического повреждения дыхательной системы способствует персонализации тактики респираторной поддержки у детей с ОНМТ и ЭНМТ и снижению заболеваемости БЛД.
Цель исследования - оценка роли факторов респираторной терапии в формировании БЛД у глубоконедоношенных новорожденных с массой тела при рождении менее 1500 г.
Материал и методы
В исследование были включены 97 недоношенных новорожденных, проходивших лечение в ОРИТН ФГБУ "Ивановский научно-исследовательский институт материнства и детства им. В.Н. Городкова" Минздрава России (табл. 1). Все дети были сроком гестации <32 нед, массой тела при рождении <1500 г, имели дыхательные нарушения и требовали того или иного вида респираторной терапии. В зависимости от исхода респираторной патологии дети были разделены на две клинические группы: 1-я группа - сформировавшие БЛД в исходе дыхательных нарушений (n=50), 2-я группа - выздоровевшие от респираторной патологии (n=47).
Клиническое обследование новорожденных включало анализ данных материнского анамнеза (социально-биологического, соматического, акушерско-гинекологического), течения беременности и родов. Наблюдение за детьми проводили ежедневно до выписки из стационара, оно включало клинико-лабораторную и инструментальную оценку состояния органов и систем. Проведен анализ способов первичной респираторной стабилизации в родовом зале, среди которых: масочная ИВЛ, эндотрахеальная ИВЛ, применение постоянного положительного давления в дыхательных путях (Continuous Positive Airway Pressure, СРАР) как при помощи лицевой маски, так и с использованием мононазальной трубки или биназальных канюль, маневр продленного раздувания легких и изолированная кислородотерапия.
Всем недоношенным новорожденным, включенным в настоящее исследование, проводили комплекс первичной реанимационной помощи в родовом зале, согласно документам, регламентирующим алгоритм ее проведения [17, 18].
Заместительная терапия сурфактантом проводилась согласно современным клиническим рекомендациям [17] и была представлена профилактическим введением (первые 20 мин жизни) всем детям, родившимся на сроке гестации 26 нед и менее, а также новорожденным со сроком гестации менее 30 нед без проведения антенатальной профилактики стероидами и/или потребовавшим интубации трахеи для стабилизации кардиореспираторной функции в первые минуты жизни. Раннее терапевтическое введение выполняли при прогрессировании дыхательной недостаточности (зависимость от кислорода более 40% на фоне проведения СРАР или DuoPAP) в первые 3-6 ч жизни. В родовом зале сурфактант вводился стандартным способом (с использованием эндотрахеальной трубки) и неинвазивным способом (Less Invasive Surfactant Administration, LISA). Во всех случаях был использован препарат порактант-альфа (Куросурф, Chiesi, Италия) в дозировке 200 мг/кг.
У новорожденных, находящихся на респираторной поддержке методом СРАР, которым ранее выполнялось профилактическое или раннее терапевтическое введение сурфактанта, повторное введение порактанта-альфа при переводе их на эндотрахеальную ИВЛ проводилось в связи с прогрессированием дыхательной недостаточности (потребность в 02 более 30% у пациентов с массой тела менее 1000 г и более 40% у детей с массой тела более 1000 г) в первые сутки жизни. Помимо этого, повторную заместительную терапию сурфактантом получали дети на эндотрахеальной ИВЛ, которым уже был введен сурфактант, при ужесточении параметров ИВЛ (МАР более 7,0 см вод.ст. и 02 >30% у пациентов с ЭНМТ и более 40% у детей с ОНМТ). В этом случае дозировка препарата составляла 100 мг/кг, препарат вводили через эндотрахеальную трубку.
Особое внимание было уделено оценке дыхательной недостаточности, показателям респираторной механики и мониторингу показателей газообмена. Оценка максимального среднего давления в дыхательных путях была проведена всем новорожденным, находящимся на эндотрахеальной ИВЛ, высокочастотной осцилляторной ИВЛ и неинвазивной одноуровневой и двухуровневой респираторной поддержке (CPAP/DuoPAP) (n=85). Максимальное значение экспираторного дыхательного объема (Vte) было проанализировано у детей, находящихся на эндотрахеальной ИВЛ (n=60). Максимальное значение O2 было рассмотрено у всех новорожденных, включенных в настоящее исследование. Информация о средних величинах рассматриваемых параметров была получена с использованием трендов респираторного мониторинга и карт интенсивного наблюдения.
Неинвазивная респираторная поддержка была представлена методом CPAP и режимом неинвазивной вентиляции DuoPAP, эндотрахеальная респираторная поддержка - режимами с управляемым давлением и мониторируемым дыхательным объемом. В большинстве случаев применяли алгоритмы вентиляции, основанные на пациент-триггерной ИВЛ (Patient Triggered Ventilation, PTV), среди них: режим принудительно-вспомогательной ИВЛ (A/C - Assist-Control) и синхронизированная перемежающаяся принудительная вентиляция с поддержкой спонтанного дыхания давлением (Synchronized Intermittent Mandatory Ventilation + Pressure Support Ventilation, SIMV + PSV). Однако в случаях нерегулярных дыхательных попыток, отсутствия спонтанного регулярного дыхания или стойкой гипердинамической дыхательной недостаточности, требующей медикаментозной седации, предпочтение отдавалось режиму перемежающейся принудительной вентиляции (Intermittent Mandatory Ventilation, IMV) с управляемым давлением.
Статистическую обработку полученных данных выполняли с использованием пакета прикладных программ Microsoft Excel 2010, Statistica 10.0 (Statsoft Ink, США), система Open Epi (http://www.openepi.com). В связи с тем, что распределение изучаемых параметров отличалось от нормального, для оценки различий использовали критерий Манна-Уитни для несвязанных выборок, точный критерий Фишера для малых выборок; численные характеристики представлены в формате: медиана (Ме) [Q25%; Q75%]. Различия считали статистически значимыми при p<0,05. С целью сравнения влияния отдельных факторов риска на исследуемые группы отношение рисков (OP)] c определением 95% доверительного интервала (ДИ).
Результаты и обсуждение
С целью восстановления и стабилизации дыхательной функции применялись следующие способы респираторной терапии: масочная ИВЛ, эндотрахеальная ИВЛ, применение постоянного положительного давления в дыхательных путях как при помощи лицевой маски, так и с использованием мононазальной трубки или биназальных канюль, маневр продленного раздувания легких и изолированная кислородотерапия. Перечисленные выше способы могли быть как изолированными, так и комбинированными в зависимости от клинической ситуации и потребности в том или ином объеме респираторной поддержки, однако в сравнительный анализ включали вид респираторной терапии, при котором произошли стабилизация и транспортировка новорожденного в ОРИТН. Для восстановления дыхания применяли маневр продленного раздувания легких у 4 новорожденных с регулярной частотой сердечных сокращений, которые не имели спонтанных инспираторных попыток. 9 новорожденным не требовалось проведение механической респираторной поддержки в родовом зале, при этом дополнительно использовали кислород (02>21%) (рис. 1).
Анализ способов стабилизации дыхания в родовом зале позволил установить, что все новорожденные, сформировавшие БЛД, потребовали проведения механической респираторной поддержки. Детям 1-й группы по сравнению со 2-й достоверно чаще требовалось проведение ИВЛ под положительным давлением через эндотрахеальную трубку [64,0 и 31,9% соответственно, р=0,001; 0Р=3,793 (ДИ 1,633-8,806)] и масочной вентиляции [74,0 и 40,4% соответственно, р=0,001; OR=4,194 (ДИ 1,776-9,906)]. Кроме того, использование дополнительного кислорода (более 21%) чаще регистрировалось в 1-й группе, а не во 2-й [96,0 и 44,7% соответственно, р=0,001; 0Р=29,71 (ДИ 6,455136,8)]. Опираясь на полученные данные, можно предположить, что на формирование хронической бронхолегочной патологии у глубоконедоношенных новорожденных влияют способы респираторной терапии, используемые уже на этапе родового зала. Все они связаны с применением дополнительного кислорода в дыхательной смеси и перемежающегося положительного давления (эндотрахеальная и масочная ИВЛ). Необходимо подчеркнуть, что отсутствие необходимости в проведении механической респираторной поддержки под положительным давлением в первые минуты жизни снижает риск формирования БЛД.
Всего 38 детей из числа обследованных потребовали введения сурфактанта в родовом зале. В 3 случаях использовали технику малоинвазивного эндотрахеального введения сурфактанта. Новорожденным с диагностированным БЛД вводили сурфактант с профилактической целью в 62,0% случаев, а в группе новорожденных без признаков БЛД - в 14,9% случаев, что оказалось статистически значимым [p=0,001; 0Р=9,328 (ДИ 3,481-24,970)].
На этапе ОРИТН раннее терапевтическое введение экзогенного сурфактанта было проведено в 1-й группе - в 12 (25,5%) случаев, во 2-й группе - в 11 (22%) введений (p>0,05). Повторного введения сурфактанта в 22 (44,0%) случаях потребовали пациенты с БЛД. Новорожденным, у которых в исходе респираторных нарушений не сформировалось хроническое повреждение бронхолегочной системы (2-я группа), повторно сурфактант не вводили. Это свидетельствует о более выраженной потребности в заместительной терапии сурфактантом у новорожденных с БЛД ввиду более тяжелых дыхательных нарушений.
Пролонгированная респираторная терапия на этапе ОРИТН была представлена различными видами респираторной поддержки, оксигенотерапией и их комбинацией (рис. 2).
Установлено, что более чем в половине случаев у новорожденных с диагностированной БЛД в комплекс механической респираторной терапии была включена схема респираторной терапии "CPAP/DuoPAP + эндотрахеальная ИВЛ + оксигенотерапия", в то время как у новорожденных, выздоровевших от дыхательных нарушений, эту комбинацию способов вентиляции применяли достоверно реже [56,0 и 25,5% соответственно, р=0,002; 0Р=3,712 (ДИ 1,546-8,783)]. Всем новорожденным с БЛД потребовалось проведение того или иного способа ИВЛ с использованием положительного давления в дыхательных путях. Изолированную оксигено-терапию (без ИВЛ) как способ стабилизации дыхательной функции не применяли в группе детей с БЛД, в то время как 1/4 новорожденных без БЛД потребовалась оксигеноте-рапии без использования положительного давления в дыхательных путях (0 и 25,6%, р=0,001).
Таким образом, в нашем исследовании установлено, что использование пролонгированной эндотрахеальной ИВЛ в комплексе с другими видами респираторной поддержки способствует формированию хронического повреждения легочной ткани, и это согласуется с данными, свидетельствующими о травмирующих свойствах агрессивных факторов эндотрахеальной вентиляции [20].
Рассматривая ИВЛ под положительным давлением как ведущий экзогенный фактор, способствующий реализации БЛД, нами были проанализированы такие показатели вентиляционной поддержки, как среднее давление в дыхательных путях, экспираторный дыхательный объем и фракция кислорода во вдыхаемой смеси (Fi02). Согласно современным представлениям, именно эти факторы и/или их совокупность определяют степень агрессии респираторной терапии [21, 22].
Тяжелые нарушения газообмена, сопровождающиеся увеличением потребности в проведении механической вентиляции, требуют применения высоких значений МАР, что является значимым фактором риска формирования БЛД у глубоконедоношенных новорожденных [23]. Проведенный анализ в рамках нашего исследования позволил установить, что среднее значение максимального МАР было достоверно выше в группе новорожденных с БЛД по сравнению с группой новорожденных без признаков БЛД (p=0,001) (табл. 2).
Аналогичная закономерность выявлена и для значения максимального экспираторного дыхательного объема. Было показано, что высокие значения Vte при проведении ИВЛ с управляемым давлением достоверно чаще встречались у новорожденных, которые впоследствии сформировали бронхолегочную дисплазию (р=0,001). Полученные нами данные свидетельствуют о том, что тяжелые нарушения газообмена, диктующие необходимость увеличения минутного объема вентиляции с целью элиминации двуокиси углерода и соответственно дыхательного объема, могут быть причиной динамического перерастяжения альвеол и объемно-ассоциированного повреждения легких недоношенного ребенка, что согласуется с данными других авторов [24, 25] и, следовательно, способствует развитию БЛД.
Данные, полученные при анализе потребности в дополнительном кислороде, свидетельствуют о том, что в среднем для обеспечения оптимальной оксигенации детям без БЛД потребовалась почти в 2 раза менее концентрированная кислородно-воздушную смесь, чем детям с БЛД (р=0,001). Значительно более высокое среднее значение максимального FiO2 в группе новорожденных с БЛД подтверждает концепцию о роли свободных радикалов и оксидативного стресса в реализации осложнений, ассоциированных с ИВЛ, и, как следствие, формировании хронических заболеваний легких у глубоконедоношенных новорожденных [16].
Наряду с вышеуказанными параметрами ИВЛ (МАР, Vte и FiO2) был проведен анализ общей длительности их совокупного воздействия на бронхолегочную систему глубоконедоношенных новорожденных за время пребывания в отделении реанимации и интенсивной терапии. Средняя длительность респираторной терапии в группе новорожденных с БЛД оказалась выше более чем в 4 раза и составила 210,0 (118,0; 398,0) ч, а в группе новорожденных без БЛД - 53,0 (34,0; 142,0) ч (р=0,001). Данная закономерность является очевидной и объясняется увеличением длительности воздействия повреждающих факторов ИВЛ на незрелые легкие новорожденного.
При проведении традиционной эндотрахеальной ИВЛ выбор режима респираторной поддержки осуществлялся индивидуально и зависел главным образом от тяжести нарушений газообмена, ритма дыхания и регулярности инспираторных попыток, а также от уровня сознания пациента.
Статистически значимых различий в изучаемых группах по частоте использования пациент-триггерных алгоритмов респираторной поддержки (A/C, SIMV+PSV) не обнаружено (рис. 3).
Несинхронизированная ИВЛ (IMV) значимо чаще была использована для стабилизации респираторной функции у новорожденных 1-й группы по сравнению с детьми из 2-й группы [42,1 и 14,3% соответственно, р=0,026; ОР=4,367 (ДИ 1,096-17,370)]. Полученные нами результаты согласуются с данными зарубежных авторов, которые указывают на увеличение случаев реализации БЛД и длительности респираторной поддержки при проведении ИВЛ без аппаратного триггирования [26].
Выводы
Таким образом, проведенное исследование выявило следующие агрессивные факторы респираторной поддержки, влияющие на формирование БЛД у глубоконедоношенных новорожденных:
■ использование масочной и эндотрахеальной ИВЛ в родовом зале в качестве методов первичной стабилизации респираторной функции;
■ использование эндотрахеальной ИВЛ в комплексе с неинвазивной вентиляцией и оксигенотерапией;
■ высокие максимальные значения агрессивных факторов ИВЛ (среднее давление в дыхательных путях, экспираторный дыхательный объем, фракция кислорода во вдыхаемой смеси) и длительность их суммарного воздействия;
■ использование несинхронизированных алгоритмов эндотрахеальной ИВЛ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Распоряжением Правительства Российской Федерации от 18 ноября 2019 г. № 2732-р была утверждена Концепция осуществления государственной политики противодействия потреблению табака и иной никотинсодержащей продукции в Российской Федерации на период до 2035 года и дальнейшую перспективу (Концепция).
Наряду с важными положениями, направленными на сокращение потребления населением табака, в Концепции впервые содержатся меры, направленные на защиту населения от никотиновой зависимости необходимо отметить меры, направленные на сокращение никотинсодержащей продукции, включая электронные средства доставки никотина и электронные средства нагревания табака.
В основу Концепции заложен принцип единого регулирование табака и иной никотинсодержащей продукции, основываясь на ранее данном поручении Председателя Правительства Российской Федерации
Необходимость регулирования никотинсодержащей продукции связана с ростом потребления электронных средств доставки никотина и электронных средств нагревания табака во всем мире, прежде всего среди молодежи.
Лекарства от остеопороза двойного действия, миниинвазивная хирургия митрального клапана и новое лечение аллергии на арахис — один из крупнейших частных медицинских центров США Cleveland Clinic составил свой топ инноваций, которые могут внести значительный вклад в развитие медицины в наступающем году.
1. Препарат для лечения остеопороза двойного действия — Ромосозумаб
В апреле Управление по санитарному надзору за качеством пищевых продуктов и лекарственных препаратов США (FDA) одобрило Ромосозумаб — первый препарат для лечения остеопороза, который одновременно стимулирует синтез костной ткани и уменьшает ее резорбцию. Препарат представляет собой моноклональное антитело, которое блокирует активность белка склеростина, выпускается в инъекционной форме с кратностью применения один раз в месяц.
Ромосозумаб показан женщинам в постменопаузальном периоде с остеопоротическими переломами в анамнезе или множественными факторами риска переломов, а также женщинам с непереносимостью других видов лечения остеопороза.
2. Расширение использования минимально инвазивной хирургии митрального клапана
Хорошие новости для сердечно-сосудистых хирургов. Минимально инвазивное восстановление митрального клапана с помощью MitraClip (Abbott) впервые получило одобрение в США в 2013 году для лечения пациентов с первичной митральной регургитацией и противопоказаниями к проведению операции на открытом сердце. Учитывая, что примерно один из 10 человек в возрасте старше 75 лет страдает от регургитации митрального клапана, использование данной методики дает шанс на счастливую здоровую старость тысячам пациентов. На этом хорошие новости не заканчиваются. В марте FDA расширило рекомендации по применению устройства, включив пациентов с вторичной митральной регургитацией, предоставляя право на альтернативный, возможно более безопасный вариант лечения еще большему количеству пациентов.
3. Лечение транстиретин-амилоидной кардиомиопатии
Транстиретин-опосредованная амилоидная кардиомиопатия (ATTR-CM) является редким, быстро прогрессирующим и часто смертельным заболеванием. Патогенез этой кардиомиопатии связан с отложением амилоидных фибрилл в миокарде.
В 2019 году FDA утвердила первый в мире препарат для лечения взрослых с ATTR-CM. Было показано, что тафамидис меглумин и тафамидис предотвращают неправильное отложение депонированного белка и значительно снижают риск смерти у таких пациентов.
4. Лечение аллергии на арахис
Аллергия на арахис является одной из самых распространенных пищевых аллергий. В сентябре группа FDA рекомендовала препарат Palforzia детям с аллергией на арахис. В случае одобрения препарат, представляющий собой «порошок аллергена», станет первым в своем классе пероральным средством иммунотерапии для пациентов с аллергией на арахис. Во время лечения этим препаратом в организм пациента будет поступать малое количество аллергена. Считается, что небольшие дозы аллергена, медленно поступающие в организм в течение достаточно долгого времени, могут ослабить чувствительность гиперактивной иммунной системы. Препарат представляет собой безвкусный порошок, применяемый перорально один раз в день с пищей.
Группа экспертов пришла к выводу, что хотя это и не лекарство в чистом виде, но применение этого препарата уменьшает последствия от случайного контакта ребенка с аллергеном, а также облегчает психологическое состояние родителей, которые живут в постоянном страхе.
5. Стимуляция спинного мозга с замкнутым циклом
Хроническая боль в спине и ногах является распространенной проблемой и основной причиной назначения опиоидных препаратов.
Стимуляция спинного мозга с использованием имплантируемого в эпидуральное пространство устройства, электроды которого активизируют тормозящие нейроны в заднем роге спинного мозга, уменьшая чувство боли, является популярным методом лечения хронической боли.
Тормозящим фактором для широкого применения этой методики является частая чрезмерная стимуляция спинного мозга. Новая методика с замкнутым циклом позволяет улучшить связи между устройством и спинным мозгом, благодаря чему пациенты получают выраженное облегчение боли, лучше спят и принимают меньше лекарств.
6. Биологические препараты в ортопедии
Биологические препараты — клетки, компоненты крови, факторы роста и другие природные вещества — получили применение в ортопедии. Использование собственных возможностей организма может способствовать заживлению разрыва или частичного повреждения передней крестообразной связки и уменьшить выраженность воспаления.
Новая методика представляет собой использование губки, инъецированной биологическими факторами в сочетании с собственной кровью пациента. Наложение такой губки способно стимулировать заживление связки, сохраняя ее ткань. Испытания методики продолжаются, и эксперты клиники надеются на благоприятные результаты уже в наступающем году.
7. Пленка из антибиотиков для профилактики инфекций, вызванных имплантацией сердечных устройств
Ежегодно во всем мире около 1,5 миллионов пациентов проходят процедуру имплантации кардиостимулятора. Но в 1–4 % случаев имплантация осложняется развитием инфекционного процесса. Недавняя инновация в виде применения имплантируемой пленки с антибиотиком обеспечивает доставку двух противомикробных препаратов локально в течение 7 дней после имплантации, сводя к минимуму риск заражения.
Методика получила разрешение FDA в 2013 году, но хирурги не спешили применять ее, с нетерпением ожидая результатов всемирного рандомизированного исследования WRAP-IT. По данным клиники Кливленда результаты, опубликованные в марте, свидетельствуют о снижении числа инфекционных осложнений на 40 %, что делает процедуру имплантации кардио устройств более безопасной для пациентов.
8. Бемпедоевая кислота для снижения уровня холестерина у пациентов с непереносимостью статинов
Применяемые для снижения уровня холестерина статины вызывают мышечные боли у 10 % пациентов. Новый препарат — бемпедоевая кислота — обеспечивает альтернативный подход к снижению уровня холестерина, позволяя избежать побочных эффектов статинов. В отличие от них бемпедоевая кислота не накапливается в мышцах, что снижает вероятность возникновения боли.
В клинических испытаниях препарат снижал уровень ХС-ЛПНП в среднем примерно на 25 %. В случае одобрения FDA, бемпедоевая кислота может стать еще одним дополнением в арсенале препаратов для снижения уровня холестерина.
9. Ингибиторы PARP в качестве поддерживающей терапии рака яичников
Ингибиторы поли(АДФ-рибоза)-полимеразы (PARP) являются одним из последних важных достижений в лечении рака яичников. Эти препараты улучшают выживаемость без прогрессирования заболевания и в настоящее время рассматриваются в качестве поддерживающей терапии первой линии на поздних стадиях заболевания.
В марте анализ 3 фазы NOVA показал, что Нирапариб обеспечивает значимые клинические преимущества для пациентов с рецидивирующим раком яичников по сравнению с плацебо.
По словам экспертов в настоящее время проводится несколько дополнительных крупномасштабных испытаний, в которых ингибиторы PARP добились больших успехов в улучшении результатов лечения.
10. Препараты для лечения сердечной недостаточности с сохраненной фракцией выброса
В настоящее время нет лекарств, специально предназначенных для лечения сердечной недостаточности с сохраненной фракцией выброса.
Однако ингибиторы натрий-глюкозного котранспортера 2 типа (SGLT2), используемые для лечения диабета 2 типа, в настоящее время изучаются в нескольких текущих исследованиях. Интерес к применению ингибиторов SGLT2 для лечения СН вызван следующим наблюдением: они снижают риск сердечно-сосудистой смерти и повторных госпитализаций по поводу сердечной недостаточности в когорте пациентов с диабетом 2 типа.
Ингибиторы SGLT2 также показали сходные результаты у пациентов без диабета с сердечной недостаточностью и сниженной фракцией выброса. Как отметили в клинике Кливленда, решение FDA по данному препарату ожидается в 2020 году.
Ученые из Научно-исследовательского института Скриппса и некоммерческой организации исследований вакцин против ВИЧ (IAVI) смогли создать препарат, который воздействует на широкий спектр штаммов этого вируса. Статья опубликована в издании Immunity.
ВИЧ, которым на сегодня больны как минимум 38 миллионов человек, все еще остается серьезной проблемой. Антиретровирусная терапия помогает уже больным людям снизить вирусную нагрузку. Благодаря этому болезнь не переходит в терминальную стадию, и человек может более-менее полноценно жить долгие годы, не заражая других. Однако пожизненная длительность приема лекарств, дороговизна препаратов и невозможность излечить заболевание делают приоритетным направлением исследований в этой области создание профилактической вакцины.
Основная проблема на этом фронте — изменчивость вируса и его защищенность. Цель этой, как и многих предыдущих работ, — найти такие виды антител, которые будут работать на многих штаммах сразу. Авторы статьи вплотную приблизились к решению. Им удалось обнаружить антитела, которые связываются с критическими участками вируса, не сильно различающимися у разных штаммов.
Ученые взяли за основу протеин, имитирующий белок Env вируса иммунодефицита человека. Эти «кустистые» белки покрывают поверхность вируса, поэтому при попадании возбудителя в организм Env — первое, что могут «увидеть» иммунные клетки человека.
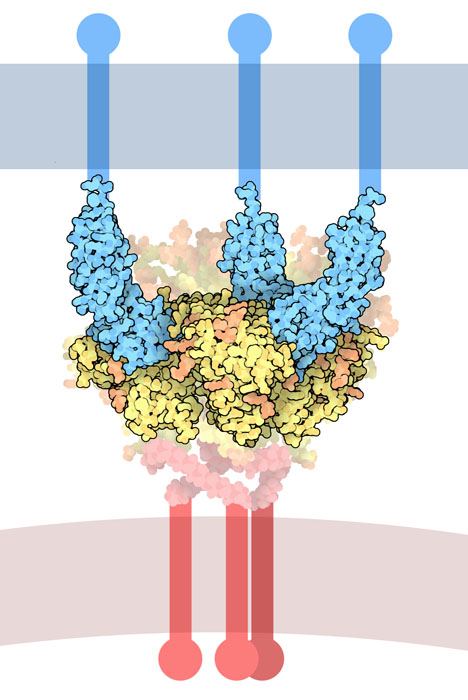 https://naked-science.ru/wp-content/uploads/2019/11/169-HIVEnvelopeGlycoprotein_1gc1_composite-201x300.jpg 201w" data-sizes="(max-width: 468px) 100vw, 468px" sizes="(max-width: 468px) 100vw, 468px" srcset="https://naked-science.ru/wp-content/uploads/2019/11/169-HIVEnvelopeGlycoprotein_1gc1_composite.jpg 468w, /https://naked-science.ru/wp-content/uploads/2019/11/169-HIVEnvelopeGlycoprotein_1gc1_composite-201x300.jpg 201w" style="margin: 0px; padding: 0px; font: inherit; vertical-align: baseline; opacity: 1; transition: opacity 300ms ease 0s; max-width: 100%; border-radius: 8px; display: block;">Графическая визуализация связывания вирусного гликопротеина Env (внизу) с CD4-рецепторами лимфоцитов (вверху) / © PDB-101
https://naked-science.ru/wp-content/uploads/2019/11/169-HIVEnvelopeGlycoprotein_1gc1_composite-201x300.jpg 201w" data-sizes="(max-width: 468px) 100vw, 468px" sizes="(max-width: 468px) 100vw, 468px" srcset="https://naked-science.ru/wp-content/uploads/2019/11/169-HIVEnvelopeGlycoprotein_1gc1_composite.jpg 468w, /https://naked-science.ru/wp-content/uploads/2019/11/169-HIVEnvelopeGlycoprotein_1gc1_composite-201x300.jpg 201w" style="margin: 0px; padding: 0px; font: inherit; vertical-align: baseline; opacity: 1; transition: opacity 300ms ease 0s; max-width: 100%; border-radius: 8px; display: block;">Графическая визуализация связывания вирусного гликопротеина Env (внизу) с CD4-рецепторами лимфоцитов (вверху) / © PDB-101
CD4-рецептор иммунной клетки нужен, чтобы Т-лимфоциты «поняли», кто атакует организм и как бороться с захватчиком. Коварство Env заключается в том, что он умеет смонтировать из наших иммунных клеток своего рода троянского коня. Env мгновенно связывается с CD4-рецепторами в момент «прощупывания», проникает сквозь него внутрь клетки, нейтрализует ее и так спокойно проникает в организм.
Созданный исследователями протеин моделирует основные структуры Env, оставаясь при этом стабильным настолько, чтобы служить основой для вакцины. Вместо самих круглых «тел» вируса, на которых гнездятся настоящие Env, авторы смоделировали искусственные микросферы из жировых клеток, на поверхности которых разместили сконструированные белки.
Настоящий вирус защищает сайты связывания Env с CD4-рецепторами специальным щитом, сделанным из полисахаридов гликанов. Созданный исследователями «псевдовирус» имеет незащищенные участки, чтобы иммунные клетки могли «взглянуть в лицо» врага. «Идея заключалась в том, чтобы лучше обнажить этот сайт и тем самым стимулировать широкую реакцию антител на него с самого начала», — объясняет автор работы доктор Ричард Уайетт.
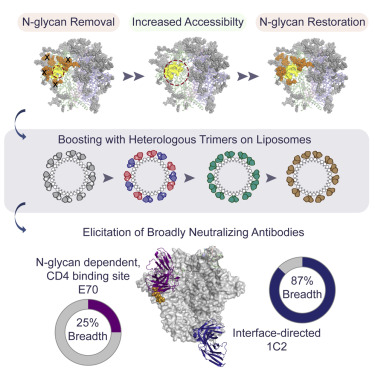 https://naked-science.ru/wp-content/uploads/2019/11/fx1-300x300.jpg 300w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-150x150.jpg 150w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-170x170.jpg 170w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-80x80.jpg 80w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-90x90.jpg 90w" data-sizes="(max-width: 375px) 100vw, 375px" sizes="(max-width: 375px) 100vw, 375px" srcset="https://naked-science.ru/wp-content/uploads/2019/11/fx1.jpg 375w, /https://naked-science.ru/wp-content/uploads/2019/11/fx1-300x300.jpg 300w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-150x150.jpg 150w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-170x170.jpg 170w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-80x80.jpg 80w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-90x90.jpg 90w" style="margin: 0px; padding: 0px; font: inherit; vertical-align: baseline; opacity: 1; transition: opacity 300ms ease 0s; max-width: 100%; border-radius: 8px; display: block;">Схема вакцинации, проведенной учеными. Сперва ученые проводили иммунизацию вирусом с незакрытым белком Env, а затем — с полностью защищенным гликановым «щитом». Роль вирусных оболочек играли жировые микросферы / © Dubrowskaya, Tran, Ozorowski et al., Immunity, 2019.
https://naked-science.ru/wp-content/uploads/2019/11/fx1-300x300.jpg 300w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-150x150.jpg 150w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-170x170.jpg 170w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-80x80.jpg 80w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-90x90.jpg 90w" data-sizes="(max-width: 375px) 100vw, 375px" sizes="(max-width: 375px) 100vw, 375px" srcset="https://naked-science.ru/wp-content/uploads/2019/11/fx1.jpg 375w, /https://naked-science.ru/wp-content/uploads/2019/11/fx1-300x300.jpg 300w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-150x150.jpg 150w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-170x170.jpg 170w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-80x80.jpg 80w, https://naked-science.ru/wp-content/uploads/2019/11/fx1-90x90.jpg 90w" style="margin: 0px; padding: 0px; font: inherit; vertical-align: baseline; opacity: 1; transition: opacity 300ms ease 0s; max-width: 100%; border-radius: 8px; display: block;">Схема вакцинации, проведенной учеными. Сперва ученые проводили иммунизацию вирусом с незакрытым белком Env, а затем — с полностью защищенным гликановым «щитом». Роль вирусных оболочек играли жировые микросферы / © Dubrowskaya, Tran, Ozorowski et al., Immunity, 2019.
Вакцину с вирусом, имевшим незакрытые участки поверхности, ученые использовали при первичной прививке, а в последующей бустерной иммунизации на протяжении 48 недель они применяли вакцину с уже полностью рабочим «щитом». Это должно помочь отобрать те антитела, которые и нацелены на сайт связывания CD4-рецепторов, и способны пробиться через защиту вируса.
Тестирование на кроликах подтвердило, что сложная схема вакцинации оказалась рабочей. Удалось выделить антитела E70, которые могут блокировать сайт связывания CD4, причем необычным способом, используя в том числе захват одного из экранирующих гликанов. Другие антитела (1C2) смогли нарушить деятельность Env, атаковав его на границе раздела между двумя ключевыми сегментами этого сложного белка.
После повреждения Env утратил свою суперспособность к опосредованной помощи вирусу во вселении в организм. Кроме прочего, оказалось, что 1C2 обладает широким спектром действия. Оно показало эффективность для 87% вариантов ВИЧ из 208 проверенных. Ученые надеются, что после достаточного количества тестирований на модельных животных они смогут перейти к проверке этой вакцинации на человеке.
Ранее ученые впервые за 19 лет открыли новый штамм ВИЧ, и выяснили, что заражение некоторыми паразитами защищает людей от заражения вирусом иммунодефицита.
Новое программное обеспечение, разработанное учеными из Мичиганского университета, может предсказать, как текущие лекарства, включая даже маловероятных кандидатов, можно объединить для создания новых способов лечения туберкулеза.
Туберкулез ежегодно убивает 1,8 миллиона человек и является самой смертоносной бактериальной инфекцией в мире. Сегодня для его лечения используются 28 лекарственных препаратов, которые могут быть объединены в 24 тысячи комбинаций из трех или четырех средств. Если в смесь добавить пару новых препаратов, это увеличит количество потенциальных комбинаций до 32 тысяч.
Эти цифры делают разработку новых схем лечения трудоемкой и дорогостоящей. В то же время штаммы с множественной лекарственной устойчивостью быстро распространяются. Решить проблему может помочь искусственный интеллект. По словам ученых, он способен заменить традиционную систему проб и ошибок, которая сегодня используется для разработки лекарств и является сравнительно медленной и дорогой.
В результате долгих исследований ученым из Мичиганского университета и Нью-Йоркского университета удалось создать программный инструмент INDIGO (INferring Drug Interactions using chemoGenomics and Orthology), который показал, что эффективность противотуберкулезных препаратов может быть усилена, когда они объединяются с антипсихотическими или антималярийными препаратами.
Новый алгоритм также точно предсказывает антагонизм между препаратами, при котором активность комбинации снижается. Кроме того, он способен определить гены, контролирующие эти лекарственные взаимодействия.
INDIGO выявил несколько тысяч новых комбинаций для лечения туберкулеза. Некоторые из них, содержащие пять, четыре и три препарата, оказались наиболее действенными. А активность против бактерии, вызывающей туберкулез, в лаборатории проявили 88 процентов предсказанных препаратов
Резюме
В аналитическом обзоре представлены современные данные о микробиоме человека - сообществе комменсальных микроорганизмов в комплексе с генетическим материалом, молекулами межклеточного взаимодействия и средой обитания. Обозначены проблемы и актуальные перспективы изучения микро-биома, представлена информация о новых научных направлениях и достижениях в этой области. Обсуждается патогенез инфекционных и неинфекционных заболеваний с учетом сообщества микроорганизмов человека.
Ключевые слова:микробиом, микробиота, комменсальные бактерии
На протяжении последних двух десятилетий фундаментальным фактором, определяющим физиологию и патологию хозяина, признано микробное сообщество (микробиота) организма человека. Совокупность разнообразия генов микробиоты человека известна как микро-биом человека. Микробиота по числу совокупных генов в подавляющем большинстве случаев превосходит кодирующую способность генома человека и составляет более 3 млн генов [1].
Среди важных для хозяина функций микробиоты отмечены биодеградация ряда неперевариваемых полисахаридов, синтез незаменимых аминокислот и витаминов, детоксикация ксенобиотиков [2, 3]. Роль ассоциативных взаимодействий и спектр характеристик микробиома уже доказаны в ряде инфекционных и неинфекционных заболеваний человека, а современные исследования вышли далеко за пределы классического понимания значения микроорганизмов в нормальной и патологической физиологии человека.
Цель аналитического обзора - охарактеризовать современный уровень знаний микробиома человека с учетом практических результатов внедрения микробиом-ассоциированных методов лечения.
Важной инициативой на сегодняшний день является Проект микробиома человека, включающий исследования для улучшения понимания характеристик микробиоты, связанной со здоровьем и заболеваниями человека. В рамках проекта проводится секвенирование 16S рРНК бактерий микробиоты человека [4]. Большинство исследований микробиома основано на определении последовательности вариабельных областей высококонсервативного гена, кодирующего WS-субъединицу рибосомальной РНК (16S рРНК) микроорганизмов. Этот ген присутствует в бактериях, но отсутствует у млекопитающих и содержит 9 гипервариабельных областей (от V1 до V9), что позволяет идентифицировать различные бактерии.
Следует отметить, что классические микробиологические (культуральные) методы несостоятельны для исследования микробиоты человека. К сожалению, результаты посевов на среды образцов стула, слюны, влагалищного отделяемого и т.д. не отражают реального состава и плотности микробиоты. Более того, они вводят в заблуждение некоторых врачей и многих пациентов, что чревато принятием неверных решений, безосновательным назначением антибактериальных препаратов и других лекарственных средств. В связи с этим современному врачу стоит исключить из своей лексики не известные в остальном мире термины "дисбактериоз", "дисбиоз", основанные на результатах бактериологических методов диагностики патологических состояний.
Несмотря на значительное разнообразие видов микроорганизмов в составе микробиоты, большинство представителей принадлежат только к 4 типам современной биологической систематики: Bacteroidetes, Firmicutes, Actinobacteria и Proteobacteria. Типы Firmicutes и Bacteroidetes составляют >90% бактериального сообщества толстой кишки, где плотность микробиоты наибольшая. В то же время представители типов Actinobacteria и Proteobacteria практически всегда присутствуют в составе микробиоты, но их содержание относительно невысоко [5, 6].
Микробиота кишечника играет решающую роль в удалении из организма человека патогенных и условно-патогенных бактерий и предотвращении избыточного роста потенциально опасных "малочисленных" бактерий, колонизирующих желудочно-кишечный тракт (ЖКТ). Полезные функции бактерий, населяющих ЖКТ человека, обсуждались еще лауреатом Нобелевской премии И.И. Мечниковым, идеи которого послужили основой для работы многих поколений исследователей.
Возрастные изменения микробиома у детей
Эволюция и созревание кишечного микробиома на ранних стадиях жизни являются важным фактором здоровья, а нарушение формирования микробного сообщества у ребенка предрасполагает к развитию заболеваний как в младенчестве, так и в зрелом возрасте, что наиболее изучено при аллергических заболеваниях и метаболических синдромах [7-9].
Известно, что после родов кишечник новорожденного естественным путем заселяется бактериями родового канала матери, а при выполнении кесарева сечения его микробиота представлена в основном бактериями, населяющими кожу взрослого человека. При этом стрептококки доминируют в составе микробиоты таких детей [10]. Высказано предположение, что это может представлять собой фактор риска развития инфекций в детском возрасте. Весьма значимы результаты исследования, в котором после кесарева сечения была проведена обработка кожных покровов новорожденных тампоном, смоченным содержимым влагалища матери, что приводило к колонизации кожных покровов ребенка материнской микрофлорой, как у детей после родов через естественные родовые пути [11].
Исследования, включавшие тысячи детей, выявили связь между использованием антибактериальных препаратов в течение первого года жизни и риском развития бронхиальной астмы к 6-7 годам, что опосредованно подтверждает важную роль микробиома в формировании здоровья человека [12-15].
Зашитные биохимические механизмы микробиома
Представители микробиоты совместно с иммунной системой участвуют в метаболизме ряда биохимических веществ, в том числе желчных кислот, преобразуя их в токсичные продукты распада, которые способны ингибировать рост некоторых патогенов, например C. difficile [16-18].
В экспериментальных исследованиях на лабораторных животных показано, что важнейшим защитным барьером на пути колонизации патогенов являются ингибиторные короткоцепочечные жирные кислоты: ацетат, пропионат и бутират, которые продуцируют нормальные представители дифференцированной кишечной микробиоты. Исследовательской группой из США было продемонстрировано, что данные жирные кислоты, будучи терминальными продуктами расщепления растительных пищевых волокон с помощью кишечных бактерий, являются противовоспалительными медиаторами и играют важнейшую роль в кишечном гомеостазе [19]. Низкий уровень потребления растительной клетчатки приводит не только к уменьшению микробного разнообразия и продукции короткоцепочечных жирных кислот, но и к изменению микробиом-ассоциированного метаболизма в кишечнике, в частности происходит сдвиг к использованию менее эффективных энергетических субстратов, а именно эндогенных белков и мукопротеинов хозяина [20-22].
Микробиом-ассоциированнаяфармакология
В настоящее время, несмотря на большой интерес к исследованиям в области микробиома, связь между микробиомом и современной фармакологией остается крайне недооцененной. Открытие того факта, что бактерии кишечника человека участвуют в метаболизме лекарственных средств, произошло практически 100 лет тому назад [23]. Микроорганизмы кишечника человека способны воздействовать на лекарственные средства с помощью различных механизмов, которые можно классифицировать как прямые и косвенные. Прямые механизмы включают биотрансформацию лекарств или их метаболитов в вещества с измененной активностью. Косвенные механизмы включают более сложные взаимодействия микроорганизмов с лекарственными препаратами и организмом человека, что приводит к изменению метаболических и транспортных путей конкретного препарата [24].
Классический пример - сердечный гликозид дигоксин, применяемый в терапии нарушений ритма и сердечной недостаточности. Дозирование дигоксина является весьма сложным для врача из-за чрезвычайно узкого терапевтического диапазона, что делает даже незначительные колебания его концентрации клинически значимыми для пациента. Известно, что примерно у 10% пациентов определяют высокий уровень неактивного метаболита дигоксина - дигидродигоксина, что является результатом бактериального метаболизма (восстановления) ненасыщенного лактонового кольца молекулы этого лекарственного средства [25, 26]. В ряде случаев более 50% вводимого дигоксина инактивируется микробиотой кишечника, что существенно снижает его концентрацию в крови и эффективность [27].
В серии исследовательских работ, посвященных выявлению микробного вида, ответственного за столь значимое снижение эффективности дигоксина, было показано, что отдельные штаммы Eggerthella lenta (штамм DSM2243) имеют так называемый CGR-оперон (cardiac glycoside reductase), индуцируемый сердечными гликозидами, что запускает биохимический каскад, ведущий к инактивации данного лекарственного средства [28-31].
Роль кишечного микробиома в предупреждении развития инфекции, ассоциированной c Clostridium difficile
C. difficile - грамположительный анаэробный цитотоксин-продуцирующий спорообразующий микроорганизм, который в настоящее время конкурирует за лидерство среди инфекций, связанных с оказанием медицинской помощи. Несмотря на то что C. difficile-ассоциированная инфекция (КДАИ) как внутрибольничная не является новой проблемой уже более 30 лет, сейчас она достигла масштабов эпидемии [32, 33].
Являясь облигатным анаэробом, C. difficile способна сохраняться в окружающей среде и может легко передаваться восприимчивым людям за счет формирования эндоспор. Споры C. difficile, попадая в организм человека, могут прорастать в метаболически активные, вегетативные формы и размножаться в толстой кишке, где условия среды наиболее благоприятны для анаэробов. Клостридии начинают продуцировать токсины А и В, которые проникают в клетки кишечного эпителия и приводят к нарушению функции межклеточных контактов эпителиального барьера кишечной стенки [34, 35]. Данные повреждения обеспечивают дальнейший патогенез КДАИ, которая может проявляться как легкой диареей, так и псевдомембранозным колитом, с развитием потенциально опасного для жизни пациента токсичного мегаколона [36, 37].
Дальнейшее изучение потенциальных антагонистов среди представителей микробиома показало, что коммен-сальная бактерия C. scindens может ингибировать рост C. difficile за счет образования вторичных желчных кислот - дезоксихолевой и литохолевой [18]. В эксперименте было продемонстрировано, что искусственное заселение кишечника только C. scindens или данной бактерией в составе микробного коктейля защищало лабораторных животных от колонизации C. difficile и развития КДАИ на фоне введения антибактериальных препаратов. При проверке этой гипотезы было обнаружено, что наличие C. scindens в составе микробиома человека снижало риск колонизации C. difficile [18].
В рамках клинических исследований микробиома человека, проведенных группой исследователей из США, были выделены представители микробного сообщества, которые защищали от колонизации и инфекции C. difficile. Изучение микробиома было проведено в когорте 234 пациентов, перенесших аллогенную трансплантацию гемопоэтических стволовых клеток, среди которых у 53 (22,6%) пациентов развилась КДАИ. Выявлено, что присутствие микроорганизмов 3 различных бактериальных таксонов (тип Bacteroidetes, семейства Lachnospiraceae и Ruminococcaceae) коррелировало с защитой от инфекции C. difficile [38]. Следует отметить, что сохранность в микробиоме данных таксономических групп к моменту приживления трансплантата снижала риск развития C. difficile-ассоциированной инфекции на 60%, причем независимо от множества других включенных в анализ клинических и лабораторных факторов.
Механизмы устойчивости микробиома желудочно-кишечного тракта к колонизации патогенами
Прямые механизмы устойчивости к колонизации патогенами обеспечиваются способностью комменсальной микробиоты ограничивать экзогенную микробную колонизацию и предотвращать размножение эндогенных потенциально опасных бактерий при помощи факторов межбактериального взаимодействия и независимо от регуляторных процессов организма хозяина [39]. Эти механизмы включают конкуренцию за питательные вещества, продукцию бактериоцинов, секреторную систему VI типа.
Косвенные механизмы устойчивости к колонизации патогенами опосредованы регуляторными факторами хозяина, активирующими микробиом-ассоциированную защиту от экзогенных возбудителей [39]. Они включают продукцию антимикробных пептидов, поддержание эпителиального барьера кишечника, метаболизм желчных кислот.
Трансплантация фекальной микробиоты
Известно, что уже несколько десятилетий назад отдельные врачи-новаторы выполняли фекальные трансплантации от здоровых доноров, часто близких родственников, пациентам с рецидивирующими C. difficile-ассоциированными инфекциями и псевдомембранозным колитом [40]. Эффективность этого метода уже тогда впечатляла, а сегодня клинический успех достигается примерно в 90% случаев [41, 42].
Рецидивы инфекции, ассоциированной с C. difficile, могут быть очень тяжелыми, опасными, и трансплантация фекальной микробиоты (ТФМ) является наиболее эффективным методом их лечения [43, 44]. В то же время следует помнить об инфекционных рисках, которые несет эта процедура. Один из способов ограничить риски ТФМ - тщательный скрининг доноров на наличие инфекционных и воспалительных заболеваний, которые могут быть связаны с кишечным микробиомом.
Таким образом, "здоровый" разнообразный кишечный микробиом обеспечивает устойчивость к колонизации различными экзогенными патогенами. Выполнены исследования по изучению клинической эффективности ТФМ в качестве метода потенциальной терапии [45, 46]. Введение пациенту подготовленной и очищенной смеси из полезных представителей микробиома позволит достичь клинической эффективности, а также избежать рисков, связанных с трансплантацией всего комплекса бактерий кишечника. Кроме того, зная, какие именно представители микробиома являются наиболее опасными, можно попытаться избирательно воздействовать именно на них.
Микробиом и неинфекционные заболевания
Микробиом человека может способствовать развитию заболеваний с помощью целого ряда механизмов, включая продукцию токсичных веществ, способность к избыточному росту и поддержку воспалительных процессов. В центре внимания ученых по всему миру находится вопрос о роли нарушений кишечного микробиома в развитии инсулинорезистентности, эндотелиальной дисфункции, дислипидемии, повышении артериального давления, ожирении. Практический акцент ставится на то, что для предотвращения кардиометаболических заболеваний, помимо реализации уже хорошо известных профилактических мероприятий, важно сохранение разнообразного состава кишечного микробиома [47].
За последние несколько лет достигнут серьезный прогресс в изучении взаимодействий центральной нервной системы (ЦНС), локальной нервной системы кишечника с самим желудочно-кишечным трактом. Серия революционных доклинических исследований показала важную роль микробиома кишечника во взаимодействии с ЦНС. Основываясь на исследованиях с использованием мышей-гнотобионтов, было установлено, что микробиом способен влиять на эмоциональные реакции, системы регуляции стресса и болевых реакций, а также на нейромедиаторы ЦНС. В то же время для однозначных выводов в отношении функционирования оси "микробиом-ЦНС" пока не хватает объемных доказательных исследований, проведенных среди людей [48].
S. Yoshimoto и соавт. [49] сообщили, что в экспериментах по канцерогенезу у мышей с ожирением наблюдали изменения микробиома кишечника, и это приводило к увеличению продуцирования микробной дезоксихолевой кислоты в кишечнике, которая, как известно, способна вызывать повреждение ДНК. Повышенные уровни дезоксихолевой кислоты индуцируют сенесцентный секреторный фенотип у звездчатых клеток Ито печени, которые начинают выделять провоспалительные и канцерогенные факторы. Сенесцент-ные (старые) клетки, по мнению профессора J.L. Kirkland, директора Центра по изучению проблем старения в клинике Мейо (США), - это "хорошие граждане, но плохие соседи". Так их называют, когда нужно объяснить, зачем разрабатывается терапия для устранения сенесцентных клеток из организма. Считается, что эти стареющие клетки поддерживают частичную функциональность, но разрушают свою микросреду. Сенесцентные клетки не могут делиться, зато они активно выделяют ряд медиаторов воспаления, в том числе цитокины, хемокины и протеазы, благодаря так называемому сенесцентному секреторному фенотипу, ассоциированному с процессом старения. Число клеток с таким секреторным фенотипом увеличивается во многих тканях с возрастом [50-53].
Эксперимент S. Yoshimoto и соавт. показал, что, в отличие от контрольной группы, у мышей с нарушениями состава микробиома, ожирением и сенесцентным секреторным фенотипом клеток Ито после нагрузки химическим канцерогеном быстро развивался рак печени [49]. Полученные экспериментальные данные позволяют считать, что бактериальные метаболиты кишечника могут способствовать развитию рака печени на фоне ожирения.
На протяжении многих лет активных исследований с помощью традиционных микробиологических методов, а именно культивирования на питательных средах и микроскопии, изучали микробиоту влагалища. На основе этих работ состав микробиоты оценивали "здоровым", когда в нем преобладали перекись-продуцирующие Lactobacillus spp. с наибольшей долей среди них L. crispatus. Внедрение за последнее десятилетие молекулярно-генетических методов значительно углубило понимание структуры и вариаций микробиоты влагалища в норме и при патологии. Теперь ясно, что разнообразие бактериальных видов в ее составе намного сложнее, чем признавалось в раннее опубликованных работах [54].
Наиболее активно исследуют вопрос: какие характеристики микробиома влагалища могут быть предикторами преждевременных родов? Получены первые данные, например R.W. Hyman и соавт. показали, что беременные с более высоким содержанием лактобацилл во влагалище имели меньший риск преждевременных родов [55].
Влагалищный микробиом значительно варьирует на протяжении всей жизни женщины и ассоциирован с рядом физиологических и патологических состояний. Считавшиеся ранее стерильными органы женской репродуктивной системы, оказывается, содержат небольшие количества бактерий. Влияние на микробиом влагалища антибактериальных препаратов еще предстоит более точно изучить, а системный анализ микробиома в аспекте репродуктивного здоровья, несомненно, прольет свет на наиболее значимые нарушения в этой сфере.
Перспективы изучения микобиома и вирома человека
Бактериальный микробиом более или менее изучен, однако гораздо меньше известно о микобиоме и вироме. Как бактерии, так и грибы, вирусы, очевидно, весьма разнообразно представлены в кишечнике, и уже есть данные о том, что они также вступают во взаимодействие с иммунной системой организма хозяина [56-59]. При этом все еще не ясно, какие функции грибы и вирусы выполняют в поддержании гомеостаза организма хозяина и насколько они важны для здоровья человека.
Таким образом, возможно, в будущем в клиническую практику будут внедрены методы воздействия на микро-биом пациентов с конкретными целями, как, например, профилактика атеросклероза или оптимизация лечения рака. Это может быть достигнуто в клинических условиях посредством таких вмешательств, как специализированные диеты, введение полезных микробных сообществ и персонализированная антибактериальная терапия. Уже сегодня разрабатываются новые стратегии, которые меняют тактику классической антибиотикотерапии. Цель этих стратегий -избирательное уничтожение возбудителей инфекций без повреждения микробиома или даже восстановление полезных микробных сообществ организма человека.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Резюме
Приведены результаты внедрения регионального протокола по ранней скрининговой диагностике критических врожденных пороков сердца, не выявленных антенатально, у асимптоматических врожденных пороков сердца у новорожденных методом пульсоксиметрии на этапе родильного дома по результатам годового отчета.
Ключевые слова:критические врожденные пороки сердца, пульсоксиметрии, скрининг, новорожденные
Врожденные аномалии развития в РФ занимают 2-е место в структуре младенческой смертности, причем удельный вес врожденных пороков сердца (ВПС) в структуре данной патологии составляет 40%, а показатель младенческой смертности по причине ВПС - 15,1 на 10 000 родившихся живыми [1-3]. В Российской Федерации ежегодно рождаются более 25 тыс. детей с врожденными аномалиями сердечно-сосудистой системы [3]. В последние годы сохраняется тенденция к увеличению удельного веса тяжелых комбинированных ВПС с частым неблагоприятным исходом уже в первые месяцы жизни [4]. ВПС являются причиной 40-50% всех смертей, обусловленных аномалиями развития [5]. Основные скрининг-тесты, используемые для идентификации этих детей, включают пренатальную ультрасонографию и постнатальное клиническое обследование; однако, хотя оба этих метода доступны, у значительной части детей ВПС пропускаются [6]. По данным ряда авторов, выявляемость ВПС у плода при пренатальном ультразвуковом исследовании в учреждениях здравоохранения I уровня составляет всего 9,5%, в специализированных перинатальных центрах она достигает 43,4% [7].
Критический порок сердца - ВПС, сопровождающийся развитием критического состояния, проявляющегося острым дефицитом сердечного выброса, быстрым прогрессированием сердечно-сосудистой недостаточности, тканевой гипоксией с развитием декомпенсированного метаболического ацидоза [8]. Характерная особенность критических ВПС - отсутствие или слабая выраженность компенсаторных реакций. Если не проводится экстренная терапия (например, введение простагландинов) или не выполняется оперативная коррекция, ребенок погибает в течение первых дней или недель жизни [9]. Критические ВПС могут не проявлять себя клинически сразу после рождения, симптоматика в раннем неонатальном периоде может быть крайне скудной, что существенно затрудняет диагностику, основанную только на клиническом осмотре [9, 10].
Именно критические ВПС несут наибольшую угрозу для жизни новорожденного, так как при отсутствии специализированной неотложной помощи в течение первого месяца жизни умирают более 30% детей, а до года доживает не более 25% пациентов, которые зачастую находятся в инкурабельном состоянии [11]. Около 60% новорожденных с ВПС нуждаются в хирургическом вмешательстве; отсутствие своевременной кардиохирургической помощи увеличивает летальность и существенно снижает возможности механизмов адаптации у детей [12].
По данным ряда исследований, только 36,9% пороков сердечно-сосудистой системы диагностируются в течение первого года жизни, 21,9% - у детей 1-3 лет, а 20,3% ВПС - только в 15-18 лет [13]. Анализ диагностики жизнеугрожающих ВПС показал, что из 669 случаев только в 8% она была выполнена антенатально, в 62% - постнатально, в 25% ВПС обнаружены уже после выписки из роддома, а в 5% - после смерти [14]. Проведенное ранее в Волгоградской области исследование показало, что в 25% случаев летальность по причине ВПС можно было предупредить своевременной диагностикой и хирургической коррекцией [15].
В современной кардиохирургии отмечается отчетливая тенденция к выполнению первичных радикальных операций в периоде новорожденности. В первую очередь это касается критических ВПС, при которых ранее выполнялись паллиативные операции. Актуальными остаются вопросы ранней и точной топической диагностики, адекватной дооперационной терапии и выбора оптимальной хирургической тактики [16].
Для организации оптимальной медицинской помощи необходимо использовать формализованные технологии принятия решений (системный анализ, алгоритмы действий) [2]. Так, для ранней диагностики асимптоматических критических ВПС предлагается применять контроль сатурации крови кислородом (SpO2) в зонах кровоснабжения выше и ниже открытого артериального протока [17]. Пульсоксиметрия (ПО; токсигемометрия, гемоксиметрия) представляет собой неинвазивный метод определения степени насыщения крови кислородом, в основе которого лежит спектрофотометрический способ оценки количества гемоглобина в крови; скрининг SpO2 у новорожденных в первые 24-72 ч после рождения является объективным, доступным (не только для медицинского персонала, но и для родителей), безопасным и занимающим в среднем 7-10 мин методом диагностики, позволяющим более своевременно выявить патологию сердечно-сосудистой системы [3, 18]. Сведения о диагностической ценности данного метода разноречивы. Так, А. de-Wahl GraneLLi и соавт. [19] показали, что при использовании ПО в сочетании со стандартным клиническим обследованием почти у 40 тыс. новорожденных патология была выявлена в 92% случаев. Другие исследователи на основе данных литературных источников и собственных наблюдений утверждают, что скрининговая ПО все же недостаточно эффективна и нуждается в дальнейшем совершенствовании [10, 20]. Систематический обзор 21 рандомизированного клинического исследования (n=457 202) показал высокую специфичность и умеренную чувствительность метода ПО для скрининговой диагностики критических ВПС с очень низким уровнем ложноположительных результатов [6]. Результаты этого обзора показали, что из 10 000 практически здоровых поздних недоношенных или доношенных новорожденных 6 имели критический ВПС (медианный показатель распространенности), причем 5 из этих младенцев были выявлены с помощью ПО, а 1 случай пропущен. Кроме того, результаты ПО были ложноположительными у 14 детей из 10 000 новорожденных, причем частота ложноположительных результатов увеличивалась при проведении ПО в течение первых 24 ч жизни и уменьшалась при проведении ПО после окончания первых 24 ч жизни ребенка [6].
В 2016 г. в родовспомогательных учреждениях Волгоградской области нами был внедрен региональный протокол "Скрининговый метод диагностики врожденных пороков сердца в раннем неонатальном периоде", основанный на современных научных данных [10, 18, 21-23]. Проведены региональная научно-практическая конференция, серия обучающих семинаров в режиме видеоселекторной связи для сотрудников родильных домов, занятия в обучающем симуляционном центре по акушерству, гинекологии и перинатологии, разработаны формы отчетности.
Цель исследования - оценить диагностическую точность ПО как скринингового метода выявления бессимптомных критических ВПС у новорожденных на примере акушерских стационаров различного функционального уровня в регионе.
Материал и методы
На основании данных годового отчета проведен ретроспективный анализ результатов двухзонной ПО у 20 467 новорожденных, родившихся в акушерских стационарах Волгоградской области с января по декабрь 2017 г. Гестационный возраст детей варьировал от 34 до 42 нед (Ме=37 нед). В соответствии с региональным протоколом после подписания информированного согласия на 2-е сутки жизни всем детям проводили двухзонную ПО - последовательное измерение SpO2 на правой руке и любой ноге, длительность записи составила не менее 3 мин при отсутствии артефактов, с фиксацией результата в медицинской документации. Тест считался положительным, и ребенка направляли на эхокардиографию (ЭхоКГ) и консультацию кардиохирурга: при а) SpO2<90% на правой руке и/или любой ноге; б) SpO2=90% или <95% на правой руке и/или ноге или в) величине градиента между рукой и ногой >3%. За ложноотрицательные результаты принимают те, при которых тест расценивался как отрицательный, но в ходе проведения ЭхоКГ диагностировался критический ВПС [6, 10]. Тест считали ложноположительным, когда ВПС не был выявлен на дальнейшей ЭхоКГ.
Критериями невключения были ВПС, диагностированные пренатально; потребность в реанимации и интенсивной терапии сразу после рождения.
Критерием исключения стала клиническая манифестация ВПС в первые сутки после рождения.
Рассчитывали чувствительность, специфичность и точность метода ПО для выявления критических ВПС на этапе родильного дома.
Результаты и обсуждение
Всего за анализируемый период (с января по декабрь 2017 г.) в 2 перинатальных центрах, 8 родильных домах II уровня и 4 акушерских отделениях I уровня в соответствии с региональным протоколом "Скрининговый метод диагностики врожденных пороков сердца в раннем неонатальном периоде" выполнена ПО у 20 467 новорожденных, что составило 86,5% всех родившихся живыми в данных стационарах. Из них детей гестационного возраста от 34 до 37 нед было 2258, от 38 до 42 нед - 18 209 (табл. 1). Протокол не был внедрен в 8 акушерских стационарах I уровня, где родились 1522 ребенка, не вошедших в исследование. Таким образом, ПО была проведена у 81,3% детей, родившихся в регионе в 2017 г.
Доля доношенных новорожденных составила 89%. Основная часть ПО проведена в родильных домах II функционального уровня - 65% (см. табл. 1).
За исследуемый период на этапе родильного дома диагностированы 509 ВПС (2,2% родившихся живыми), из них пренатально - 124 (20,3%), в раннем неонатальном периоде 385 (79,7%). Большая часть ВПС диагностированы в перинатальных центрах (3,1% от живорожденных), в том числе пренатально - 32,7% (табл. 2), что свидетельствует о правильной организации маршрутизации беременных. В родильных домах I уровня за отчетный период не диагностирован ни один случай ВПС.
В табл. 3 представлены результаты ПО у новорожденных в акушерских стационарах различного функционального уровня. Положительный результат ПО был получен в 6 случаях; последующая ЭхоКГ подтвердила наличие: 2 случаев транспозиции магистральных сосудов с интактной межжелудочковой перегородкой; 2 случаев коарктации аорты, атрезии легочной артерии с интактной межжелудочковой перегородкой, тетрады Фалло. Большая часть критических ВПС выявлена методом ПО в перинатальных центрах.
Ложноотрицательные результаты ПО получены в 2 случаях - перерыв дуги аорты и коарктация аорты, что соответствует данным ряда авторов, указывающих на низкую специфичность метода ПО при диагностике данных видов ВПС [14, 20]. Диагноз в данном случае выставлялся на основании ЭхоКГ, проведенной при манифестации клинической картины сердечно-сосудистой недостаточности у детей в возрасте более 3 сут жизни.
Ложноположительные результаты ПО получены у 12 детей, причем относительная частота ложноположительных результатов отмечалась выше на I уровне, что можно объяснить организационными причинами, в частности отсутствием врачебного контроля при проведении ПО средним медицинским персоналом, отклонениями от требований протокола и пр.
Чувствительность метода ПО для диагностики критических ВПС составила 75%, специфичность - 99,9%, ценность метода - 99,9%.
Заключение
Таким образом, анализ результатов скрининга на наличие критических ВПС с помощью ПО на примере акушерских стационаров различного функционального уровня региона показал, что данный метод является объективным, доступным и безопасным методом диагностики. Большая часть критических ВПС выявлены методом ПО в перинатальных центрах, что свидетельствует о правильной маршрутизации беременных.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.