Новости
о современному определению Международной противоэпилептической лиги и Международного бюро по эпилепсии 2005 г. (ILAE, IBE, 2005), «эпилепсия — это расстройство (заболевание) головного мозга, характеризующееся стойкой предрасположенностью к генерации (развитию) эпилептических припадков, а также нейробиологическими, когнитивными, психологическими и социальными последствиями этого состояния». Эпилепсия является одним из наиболее распространенных заболеваний нервной системы. Во всем мире распространенность эпилепсии составляет 4–10/1000 человек, что соответствует 0,5–1,0 % в популяции. [1]
В Международной классификации эпилептических припадков выделяют два основных вида: генерализованные и парциальные. К генерализованным относятся тонико-клонические, тонические, клонические, миоклонические припадки и абсансы; к парциальным — простые, сложные и вторично-генерализованные. Однако большое разнообразие припадков не всегда позволяет отнести их к одному из этих видов приступов, поэтому выделена еще одна рубрика — «неклассифицированные» припадки, к которым относят 9–15 % припадков. [2] В настоящее время для дифференцирования приступов пользуются классификацией, принятой в 1981 году в Киото, Япония. Умение правильно дифференцировать приступы — необходимый компонент рационального подбора противосудорожной терапии.
Классификация форм эпилепсии весьма обширна, однако глобально можно разделить всю эпилепсию в соответствии с этиологией на:
1. Идиопатическую (генетическая (наследственная) предрасположенность при отсутствии других возможных причин заболевания); [3]
2. Симптоматическую (причиной развития заболевания становится повреждение головного мозга вследствие различных факторов, действующих во время беременности и после родов: пороки развития головного мозга (преимущественно пороки развития коры большого мозга — кортикальные дисплазии); внутриутробные инфекции; хромосомные синдромы; наследственные болезни обмена веществ; гипоксически-ишемическое поражение мозга в перинатальном периоде (во время родов, в последние недели беременности, в первую неделю жизни ребенка); инфекционные заболевания нервной системы (менингиты, менингоэнцефалиты); черепно-мозговая травма; опухоли, дегенеративные заболевания нервной системы); [3]
3. Криптогенную (эпилептические синдромы, этиология которых неизвестна или неясна. Само слово «криптогенный» переводится как тайный, скрытый. Данные синдромы еще не удовлетворяют требованиям идиопатической разновидности, однако они не могут быть причислены и к симптоматической эпилепсии).
Механизм действия противосудорожных препаратов (антиконвульсантов) до конца не изучен. Во многом это объясняется недостаточной изученностью эпилепсии как таковой, поскольку зачастую причину судорожных приступов выяснить не удается.
Важное значение в развитии эпилептогенной активности головного мозга имеет нарушение баланса между тормозными (ГАМК, глицин) и возбуждающими нейромедиаторами (глутамат, аспартат). Для возбуждающих аминокислот имеются специфические рецепторы в головном мозге — NMDA- и АМРА-рецепторы, связанные в нейронах с быстрыми натриевыми каналами. Установлено, что содержание глутамата в тканях мозга в области эпилептогенного очага увеличено. Вместе с тем, содержание ГАМК в тканях мозга больных эпилепсией понижено. [4]
Классифицируют противоэпилептические средства, обычно, исходя из их применения при определенных формах эпилепсии: [4]
I. Генерализованные формы эпилепсии
- Большие судорожные припадки (grand mal; тонико-клонические судороги):
Натрия вальпроат. Ламотриджин, Дифенин, Топирамат,
Карбамазепин, Фенобарбитал, Гексамидин.
- Эпилептический статус:
Диазепам, Клоназепам, Дифенин-натрий,
Лоразепам, Фенобарбитал-натрий, Средства для наркоза.
- Малые приступы эпилепсии (petit mal; absense epilepsia):
Этосуксимид, Клоназепам, Триметин,
Натрия вальпроат, Ламотриджин.
- Миоклонус-эпилепсия:
Клоназепам, Натрия вальпроат, Ламотриджин.
II. Фокальные (парциальные) формы эпилепсии
Карбамазепин, Ламотриджин, Клоназепам, Тиагабин,
Натрия вальпроат, Фенобарбитал, Топирамат, Вигабатрин,
Дифенин, Гексамидин, Габапентин.
Также существует классификация по “поколениям” препаратов:
I — Антиконвульсанты 1-го поколения
Фенобарбитал, Фенитоин, Карбамазепин,
Вальпроевая кислота, Этосуксимид.
II — Антиконвульсанты 2-го поколения
Фелбамат, Габапентин, Ламотриджин, Топирамат, Тиагабин,
Окскарбазепин, Леветирацетам, Зонизамид, Клобазам, Вигабатрин.
III — Антиконвульсанты 3-го поколения (новейшие, многие в стадии клинического исследования)
Бриварацетам, Валроцемид, Ганаксолон, Караберсат, Карисбамат, Лакосамид, Лозигамон, Прегабалин, Ремацемид, Ретигабин, Руфинамид, Сафинамид, Селетрацетам, Соретолид, Стирипентол, Талампанел, Флуорофелбамат, Фосфенитоин, Эсликарбазепин, DP- вальпроевая кислота.
В настоящем посте будут рассматриваться основные препараты I и II поколений.
Кроме того, классифицировать противоэпилептические средства можно исходя из принципов их действия:
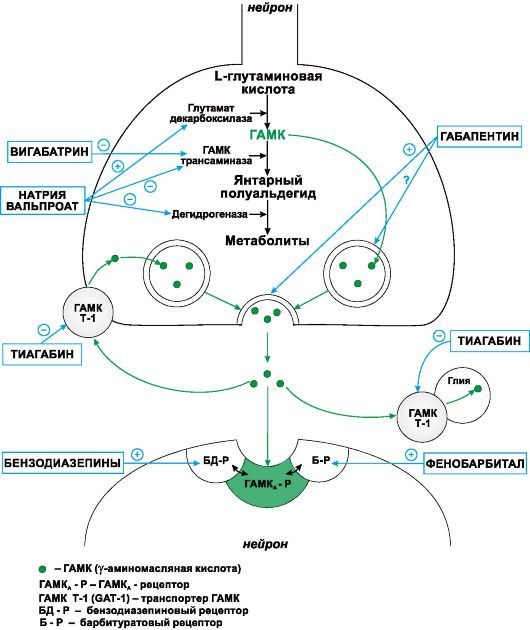
Рисунок 1. | Сайты действия различных препаратов на метаболизм ГАМК
I. Средства, блокирующие натриевые каналы:
Дифенин, Ламотриджин, Топирамат,
Карбамазепин, Натрия вальпроат.
II. Средства, блокирующие кальциевые каналы Т-типа:
Этосуксимид, Триметин, Натрия вальпроат.
III. Средства, активирующие ГАМК-ергическую систему:
1. Средства, повышающие аффинитет ГАМК к ГАМК-А-рецепторам Бензодиазепины, Фенобарбитал, Диазепам, Лоразепам, Клоназепам, Топирамат.
2. Средства, способствующие образованию ГАМК и препятствующие ее инактивации
Натрия вальпроат
3. Средства, препятствующие инактивации ГАМК
Вигабатрин
4. Средства, блокирующие нейрональный и глиальный захват ГАМК
Тиагабин
IV. Средства, понижающие активность глутаматергической системы:
1. Средства, уменьшающие высвобождение глутамата из пресинаптических окончаний
Ламотриджин
2. Средства, блокирующие глутаматные (АМPА) рецепторы
Топирамат
Блокаторы натриевых каналов
Карбамазепин (Тегретол, Финлепсин) является производным иминостильбена. Противосудорожное действие препарата обусловлено тем, что он блокирует натриевые каналы мембран нервных клеток и снижает способность нейронов поддерживать высокочастотную импульсацию, типичную для эпилептогенной активности; блокирует пресинаптические натриевые каналы и препятствует высвобождению медиатора. Препарат метаболизируется в печени, повышает скорость собственного метаболизма за счет индукции микросомальных ферментов печени. Один из метаболитов — карбамазепин-10,11-эпоксид — обладает противосудорожной, антидепрессивной и антиневралгической активностью. Выводится в основном почками (более 70 %). Побочные эффекты: потеря аппетита, тошнота, головная боль, сонливость, атаксия; нарушение аккомодации; диплопия, нарушения сердечного ритма, гипонатриемия, гипокальциемия, гепатит, аллергические реакции, лейкопения, тромбоцитопения, агранулоцитоз (требуется контроль картины крови). Существует риск развития тератогенного действия. Карбамазепин повышает скорость метаболизма, вследствие чего снижает в крови концентрацию некоторых лекарственных веществ, в том числе, противоэпилептических препаратов (клоназепама, ламотриджина, натрия вальпроата, этосуксимида и др.).
Фенитоин (Дифенин) является производным гидантоина. Противосудорожное действие: блокада натриевых каналов; уменьшение вхождения в нейроны ионов натрия; нарушение генерации и распространения высокочастотных разрядов; снижение возбудимости нейронов, препятствие их активации при поступлении к ним импульсов из эпилептогенного очага. Для предупреждения судорожных припадков фенитоин назначают внутрь в виде таблеток. Фенитоин-натрий применяют для купирования эпилептического статуса, вводят внутривенно.
Фенитоин интенсивно связывается с белками плазмы крови (на 90 %). Метаболизируется в печени, основной неактивный метаболит — 5-(п-гидроксифенил)-5-фенилгидантоин — подвергается конъюгации с глюкуроновой кислотой. В основном выводится из организма почками в виде метаболитов. Побочные эффекты: головокружение, возбуждение, тошнота, рвота, тремор, нистагм, атаксия, диплопия, гирсутизм; гиперплазия десен (особенно у молодых людей), снижение уровня фолатов и мегалобластная анемия, остеомаляция (связано с нарушением метаболизма витамина D), аллергические реакции и др. Отмечено тератогенное действие. Вызывает индукцию микросомальных ферментов в печени и таким образом ускоряет метаболизм ряда лекарственных веществ (кортикостероиды, эстрогены, теофиллин), повышает их концентрацию в крови.
Ламотриджин (Ламиктал) блокирует натриевые каналы мембран нейронов, а также уменьшает выделение глутамата из пресинаптических окончаний (что связывают с блокадой натриевых каналов пресинаптических мембран). Побочные эффекты: сонливость, диплопия, головная боль, атаксия, тремор, тошнота, кожные высыпания. [5]
Блокаторы кальциевых каналов Т-типа
Этосуксимид (Суксилеп) относится к химическому классу сукцинимидов, которые являются производными янтарной кислоты. Противосудорожное действие: блокирует кальциевые каналы Т-типа, участвующие в развитии эпилептической активности в таламокортикальной области. Является препаратом выбора для лечения абсансов. Метаболизируется в печени. В основном выводится из организма почками в виде метаболитов и около 20 % от введенной дозы — в неизмененном виде. Побочные эффекты: тошнота, рвота, дискинезия; головная боль, сонливость нарушения сна, снижение психической активности, состояние тревоги, аллергические реакции; редко — лейкопения, агранулоцитоз.
Механизм действия некоторых противоэпилептических средств включает несколько компонентов и не установлено, какой из них является преобладающим, вследствие чего эти препараты трудно отнести к одной из вышеприведенных групп. К таким препаратам можно отнести вальпроевую кислоту, топирамат.
Вальпроевая кислота (Ацедипрол, Апилепсин, Депакин) применяется также в виде вальпроата натрия. Противосудорожное действие: 1) блокирует натриевые каналы нейронов и снижает возбудимость нейронов в эпилептогенном очаге; 2) ингибирует фермент, метаболизирующий ГАМК (ГАМК-трансаминаза) + повышает активность фермента, который участвует в синтезе ГАМК (глутаматдекарбоксилаза); увеличивает содержание ГАМК в тканях головного мозга; 3) блокирует кальциевые каналы. Выводится главным образом почками в виде конъюгатов с глюкуроновой кислотой или в виде продуктов окисления. Побочные эффекты: тошнота, рвота, диарея, боли в желудке, атаксия, тремор, кожные аллергические реакции, диплопия, нистагм, анемия, тромбоцитопения, ухудшение свертываемости крови, сонливость. Препарат противопоказан при нарушении функции печени и поджелудочной железы.
Топирамат (Топамакс) обладает сложным, до конца не выясненным механизмом действия. Он блокирует натриевые каналы, а также увеличивает действие ГАМК на ГАМК-А-рецепторы. Снижает активность рецепторов возбуждающих аминокислот (предположительно, каинатных). Препарат используется для дополнительной терапии парциальных и генерализованных тонико-клонических судорог в сочетании с другими противоэпилептическими средствами. Побочные эффекты: сонливость, заторможенность, снижение аппетита (анорексия), диплопия, атаксия, тремор, тошнота. [5]
Средства, повышающие ГАМК-ергическую активность
Фенобарбитал (Люминал) взаимодействует со специфическими местами связывания (барбитуратными рецепторами), находящимися на ГАМК-А-рецепторном комплексе и, вызывая аллостерическую регуляцию ГАМК-А-рецептора, повышает его чувствительность к ГАМК. При этом увеличивается открытие хлорных каналов, связанных с ГАМК-А-рецептором, — больше ионов хлора поступает через мембрану нейрона в клетку и развивается гиперполяризация мембраны, что приводит к снижению возбудимости нейронов эпилептогенного очага. Кроме того, полагают, что фенобарбитал, взаимодействуя с мембраной нейрона, вызывает изменение ее проницаемости и для других ионов (натрия, калия, кальция), а также проявляет антагонизм в отношении глутамата. Метаболизируется в печени; неактивный метаболит (4-оксифенобарбитал) выделяется почками в виде глюкуронида, около 25 % — в неизмененном виде.
Побочные эффекты: гипотония, аллергические реакции (кожная сыпь), ощущение разбитости, сонливость, депрессия, атаксия, тошнота, рвота. Фенобарбитал вызывает выраженную индукцию микросомальных ферментов печени и поэтому ускоряет метаболизм лекарственных веществ, в том числе ускоряется метаболизм самого фенобарбитала. При повторных применениях вызывает развитие толерантности и лекарственной зависимости.
Бензодиазепины (Клоназепам) стимулируют бензодиазепиновые рецепторы ГАМК-А-рецепторного комплекса; повышается чувствительность ГАМК-А-рецепторов к ГАМК и происходит увеличение частоты открытия хлорных каналов, стимулируется поступление в клетку большего числа отрицательно заряженных ионов хлора, следствием чего является гиперполяризация нейрональной мембраны и усиление тормозных эффектов ГАМК. Побочные эффекты: усталость, головокружение, нарушение координации движений, мышечная слабость, депрессивные состояния, нарушения мышления и поведения, аллергические реакции (кожная сыпь). При длительном применении у детей клоназепам может вызвать нарушения умственного и физического развития. При парентеральном введении возможны угнетение дыхания (вплоть до апноэ), гипотензия, брадикардия. Вигабатрин (Сабрил) является структурным аналогом ГАМК и необратимо ингибирует ГАМК-трансаминазу, разрушающую ГАМК. Увеличивает содержание ГАМК в головном мозге. Вигабатрин обладает широким спектром противосудорожного действия, используется для профилактики больших судорожных припадков, эффективен при парциальных судорогах.
Габапентин (Нейронтин) создавался как липофильный структурный аналог ГАМК для стимуляции ГАМКА-рецепторов в головном мозге. Однако ГАМК-миметической активностью не обладает, но оказывает противосудорожное действие. Механизм действия не ясен, предполагается, что препарат способствует высвобождению ГАМК, не исключена возможность блокады транспортных систем возбуждающих аминокислот. Габапентин применяют как дополнение при лечении парциальных судорог. Препарат эффективен при нейропатических болях. Побочные эффекты: сонливость, головокружение, атаксия, тремор, головная боль.
Рак молочной железы (РМЖ) — это гетерогенное заболевание, включающее в себя множество молекулярных и морфологических подтипов, возникающее вне зависимости от возраста, гормонального статуса, расы и пр. и клинически проявляющееся спектром от «безобидных» до агрессивных образований.
Этиология РМЖ в настоящее время изучена недостаточно, однако можно выявить конкретные факторы, повышающие риск возникновения данного заболевания. Одним из наиболее важных факторов риска в заболеваемости РМЖ является наследственность. Семейные формы рака составляют около 20 % от всех РМЖ, однако большую часть генов, отвечающих за эти формы, только предстоит идентифицировать. Наиболее изученные мутации генов BRCA1 и BRCA2 составляют более половины от всех доминантно наследуемых мутаций, определяющих семейные формы рака. Их наличие в геноме повышает вероятность развития заболевания в 10–30 раз в сравнении со средней в популяции, а индивидуальный риск составляет до 85 %.
Такие мутации передаются достаточно редко, тем не менее, в определенных этнических группах распространенность заболевания значительно выше (например, превалентность семейной формы РМЖ у ашкенази составляет 1 случай к 40).
В генах BRCA1 и BRCA2 было выявлено более тысячи генеративных мутаций. Чаще всего они приводят к укорачиванию белковых молекул или изменению функций уже существующих белков. Интересно, что пенетрантность патогенетических мутаций генов BRCA и возраст появления первых симптомов заболевания совершенно различны даже в пределах одной семьи. Областью исследований также являются специфические мутации BRCA, возникшие в результате взаимодействия с другими генами и/или окружающей средой. Такие мутации могут служить для определения увеличения риска возникновения BRCA-опосредованного РМЖ.
BRSA1-ассоциированный рак молочной железы наиболее характерен для женщин молодого возраста и имеет более «агрессивные» характеристики, такие как:
- высокая степень гистологической дифференцировки;
- интенсивный пролиферативный рост;
- анеуплоидия;
- отсутствие рецепторов к эстрогену(ER), прогестерону (PgR) и человеческому эпидермальному фактору роста-2 (human epidermal growth factor 2 – HER2).
Такой трижды негативный подтип BRCA1-ассоциированного рака МЖ также характеризуется экспрессией генов, кодирующих цитокератины 5/6, 14 и 17, кадгерин-3. Хотя гены BRCA1 и BRCA2 кодируют множество белков с разнообразными функциями, их первоначальная роль как генов-супрессоров заключалась в поддержании геномной стабильности с помощью облегчения восстановления двухцепочечной молекулы ДНК после гомологичной рекомбинации. При потере гетерозиготности (прим. — LOH (loss of heterozygosity) – хромосомное нарушение, приводящее к потере всего гена и окружающей его хромосомной области) — то есть при утрате, изменении или угнетении «дикого», немутантного аллеля BRCA1 или BRCA2, нарушается процесс репарации ДНК, что ведет к быстрому присоединению ложных нуклеотидов (особенно во время репликации ДНК) и, в конце концов, дает начало канцерогенезу.
Также существуют гены, обладающие высокой пенетрантностью и повышающие риск возникновения заболевания, но они встречаются достаточно редко. К таким относятся TP53, PTEN, STK11/LKB1 и CDH1. Они повышают вероятность проявления заболевания в 8–10 раз, но суммарно составляют менее 1 % всех генов, являющихся причинами возникновения РМЖ. Как и BRCA1/2, эти гены являются супрессорами и передаются аутосомно-доминантно.
Повышать риск возникновения РМЖ могут мутации не только статичных, но и вариабельных элементов ДНК. Считается, что синдром Линча (доминантно наследуемое аутосомное заболевание) является фактором, увеличивающим риск возникновения РМЖ из-за генеративных мутаций в микросателлитах при нарушении репарации неспаренных оснований (mismatch repair — MMR) в генах MLH1, MSH2, MSH5, MSH6 и PMS2. Однако, по последним данным, только два гена из перечисленных — MSH6 и PMS2, непосредственно играют роль в развитии РМЖ, увеличивая вероятность возникновения заболевания в 2–3 раза. Мутации остальных генов обнаруживаются чаще при колоректальном и других видах рака.
Кроме того, последние исследования предлагают рассматривать точечные мутации (ОНП — однонуклеотидные полиморфизмы) микроРНК также в качестве фактора, повышающего вероятность возникновения заболевания. Они регулируют активность множества онкогенов и генов-супрессоров, следовательно, любые изменения в микроРНК будут отражаться на экспрессии соответствующих генов, что может модифицировать вероятность развития РМЖ. Например, проведенный недавно мета-анализ подтвердил, что ОНП, расположенные в генах pre-mir-27a и mir-196a-2, связаны со снижением риска возникновения рака молочной железы.
Подавляющее большинство РМЖ имеют спорадическое происхождение, в конечном счете их причиной является возникновение соматических и генетических изменений. Множество из них являются результатом нарушения репликации молекулы ДНК. Другие же возникают из-за воздействия экзо- и эндогенных мутагенов. Определение роли каждой выявленной мутации в процессе развития РМЖ представляет собой значительную проблему.
По данным последних исследований, подавляющее большинство выявленных соматических мутаций молекул ДНК в конкретных опухолях — это транзитные мутации-«пассажиры». Они представляют собой безвредные, биологически нейтральные изменения в структуре гена, не содействующие канцерогенезу. И, напротив, драйверные мутации-«водители», выявленные в клетках, дают преимущество в росте и развитии рака.
В действительности именно драйверные мутации находят среди раковых генов-«кандидатов» (CAN — candidate cancer genes).Благодаря множественным исследованиям был создан комплексный каталог соматических мутаций и CAN. Когда определенный драйверный ген попадает в ряд различных генов рака МЖ, возникает двухвершинный геномный ландшафт, охватывающий небольшое количество одинаково мутировавших генов. Вершины этого ландшафта соответствуют наиболее часто встречающимся мутациям, опосредующим возникновения РМЖ: TP53, CDH1, PI3K (прим. — фосфатидилинозитол-3-киназы), cyclin D, PTEN, и AKT.
С другой стороны, каждая отдельная “низменность” этого геномного ландшафта представляет собой совокупность генов, которые являются причинами РМЖ не более, чем в 5 % всех случаев. Значительная гетерогенность мутаций ДНК способна объяснить вариабельность фенотипов опухолей, их поведения и ответных реакций на лечение.
Изначально внимание ученых концентрировалось на генах «вершин», в частности потому, что только они были доступны для исследований. Однако новые данные свидетельствуют о том, что гены «низменностей» занимают центральную позицию в развитии РМЖ. Это согласуется с идеей о том, что большое количество мутаций в этих генах, уменьшающее процент их выживаемости, является направляющим фактором в процессе развития опухоли.
По новым данным, в геноме есть определенные амплифированные участки, содержащие гены, которые способны управлять канцерогенезом. Лучшим примером такого амплифицированного участка можно назвать ампликон 17q12, содержащий онкоген HER2.Этот онкоген управляет развитием наиболее агрессивного фенотипа опухоли МЖ и сейчас является мишенью моноклональной антительной терапии, пользующейся особым успехом (трастузумаб).
Было выяснено, что РНК-опосредованное вмешательство приводит к нарушению амплификации генов в ампликоне 17q12. В результате происходит снижение клеточной пролиферации и усиление апоптоза. Таким образом, ампликон 17q12 участвует в зашифровке конкретной генетической программы, влияющей на онкогенез. Существует еще несколько ампликонов, которые, в дополнение к 17q12, участвуют в развитии ракового фенотипа. Например, 11q13(CDN1)и 8q24(MYC), 20q13. Эти участки содержат наборы генов, которые участвуют в поддержании хромосомной целостности регуляции метаболизма ДНК.
Таким образом, наличие этих функционирующих ампликонов может определять ответ ДНК на повреждающие агенты, используемые в качестве противораковой терапии. Вклад генетических изменений в функционирование может проявляться в виде гиперэкспрессии не только отдельного гена, но и целых генетических «кассет» —ампликонов. Однако, благодаря развитию технологий в области идентификации и классификации генетических мутаций возникают новые возможности в диагностике и лечении каждого отдельного пациента.
Исторически раковые опухоли молочной железы классифицировались по патоморфологическим отличиям, а именно по стадии и степени дифференцировки. В качестве важных диагностических критериев, которые отражают биологию опухоли, также можно рассматривать гистологические особенности опухоли, наличие лимфососудистой инвазии и пролиферативный статус. Спустя время, знания о биологии РМЖ существенно увеличились и привели к пониманию, что рак молочной железы представляет собой гетерогенную группу опухолей, а поведение опухоли и ее ответ на лечение предопределены лежащими в основе биологическими особенностями. Современная классификация рака молочной железы основывается на иммуногистохимических (ИГХ) показателях — т. е. на экспрессии определенных биомаркеров. К таким относятся эстрогеновые рецепторы (ER), прогестероновые рецепторы (PR), рецепторы человеческого эпидермального фактора роста 2 (HER2) и пролиферативный индекс (Ki67).
Таким образом, в настоящее время опухоли молочной железы можно поделить на ER-положительные/-отрицательные, HER2-положительные/отрицательные и трижды негативные(ER-, PR-, HER2-). Показатели экспрессии этих двух маркеров в различных комбинациях могут использоваться в качестве важных диагностических критериев. Например, ответ на гормонотерапию будет существенно отличаться у опухолей ER+/HER- и ER+/HER+.
Люминальный тип рака молочной железы (ER+)
Этот тип РМЖ непосредственно связан с экспрессией эстрогена и изменениями эстроген-ассоциированных сигнальных путей. Эстроген – это стероидный гормон, который проявляет свое действие, связываясь с ядерным эстрогеновым рецептором. До связывания со своим лигандом, рецептор «скреплен определенным образом со специальными регуляторными белками и располагается в промоторном участке эстроген-зависимого гена. Это необходимо для управления процессами транскрипции множества генов, включая гены факторов роста.
Уровень экспрессии эстрогеновых рецепторов является важнейшим диагностическим критерием, поскольку демонстрирует то, как клетка будет отвечать на антиэстрогены, рекомендованные в качестве лечения всех ER+ опухолей. Для всех РМЖ люминального типа характерна высокая экспрессия эстрогеновых рецепторов(люминальные опухоли = опухоли ER+) и наличие прогестероновых рецепторов (PR+).
По результатам множества исследований, было выявлено два подтипа люминального РМЖ. Это люминальные А и Б подтипы (встречаемость (?) 40 и 20 % соответственно), основное отличие которых проявляется в экспрессии HER2 и пролиферативном индексе Ki67 (прим. — если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной).
Люминальный подтип А характеризуется достаточно низким индексом пролиферации (Ki67 < 14 %) и отсутствием экспрессии HER2, что значительно уменьшает «агрессивность» опухолей такого типа (ER+, PR+, HER2-, Ki67 < 14 %). Прогноз у пациентов с РМЖ люминального подтипа Б значительно хуже, поскольку такие опухоли являются HER2-положительными, а индекс пролиферации составляет 20 % (ER+, PR+, HER2+, Ki67³ 20 %).
Генетически возникновение опухолей подтипа А опосредовано мутациями в следующих генах:чаще всего в PIK3CA (45 %), далее MAP3K1, GATA3, TP53, CDH1и MAP2K4. Генетические изменения, характерные для опухолей подтипа Б также достаточно разнообразны (наиболее часто встречаемые мутации в генах TP53 и PIK3CA — в обоих случаях вероятность возникновения равна 29 %). В отличие от генетических механизмов возникновения РМЖ, молекулярные обладают невероятной скоростью (до нескольких минут). В таком случае, изменения в функционировании эстрогеновых рецепторов являются результатом быстрого фосфорилирования и активации важных факторов роста, включая EGFRs, инсулиноподобный фактор 1R (IGF-1R), cSRC, SCH и 85a-субъединицу PI3K.
Считается, что каскадный путь внутриклеточных реакций эстрогенового рецептора – это бесценная мишень в лечении рака молочной железы. Различные препараты способны ингибировать этот путь благодаря селективному связыванию рецепторов с ER-модуляторами (тамоксифен). Кроме того, в клинической практике используется методика, связанная с уменьшением продукции эндогенного эстрогена (ингибиторы ароматазы, овариальная абляция).
HER2-положительный тип рака молочной железы (HER2+)
Рак молочной железы типа HER2+(ER+, PR+, HER2+, Ki67 ≈ 90 %) составляет от 10 до 15 % всех случаев РМЖ. HER2 (EGFR2 илиErbB2) относится к семейству рецепторов с тирозинкиназной активностью, которое также включает EGFR (HER1, ErbB1), ErbB3 иErbB4. Лиганды, которые связываются с внеклеточными доменами ErbB1, ErbB3 и ErbB4, активируют различные киназы. Белок HER2 хоть и приобретает такую конформацию, в которой связывание с лигандами невозможно, все равно принимает участие в деятельности других рецепторов этого семейства.
Генетически, возникновение HER2-положительных опухолей опосредовано высокой частотой возникновения мутаций в TP53 (72 %) и PIK3CA (39 %). На молекулярном уровне амплификация HER2 связана с нарушением контроля G1- и S-фаз клеточного цикла при гиперэкспрессии или деградации белков, отвечающих за этот процесс (например, циклины D1, E, cdk6). Кроме того, HER2 взаимодействует с важными вторичными посредниками, участвующими в передаче сигналов в клетке, включая SH2-домен содержащие белки (Src-киназы).
ER-отрицательный тип рака молочной железы (базальноподобный)
ER-подтип представляет собой гетерогенную группу опухолей, однако наиболее часто встречающимися (50–75 %, 15–20 % от всех случаев РМЖ) являются опухоли, развившиеся из базальных клеток молочной железы. Генетические мутации, характерные для данного подтипа опухолей, чаще всего возникают в TP53 (80 %). Обычно, они лишены рецепторов к эстрогену, прогестерону и человеческому фактору роста-2 (ER-, PR-, HER2-), поэтому в клинической практике получили название трижды негативных. Характерная особенность таких опухолей заключается в гиперэкспрессии генов, отвечающих за синтез цитокератинов и пролиферацию, однако гены, регулирующие нормальное протекание клеточного цикла практически не функционируют.
Хотя базальноподобные опухоли составляют бóльшую часть всех ER-отрицательных опухолей, существуют и другие их разновидности (приблизительно 6 видов), которые наглядно подтверждают гетерогенность данной группы опухолей. Некоторые из них отличаются низким уровнем клаудина (трансмембранного белка), но при этом большей экспрессией рецепторов к интерферонам и андрогенам. Пониженный уровень клаудина приводит к нарушению функционирования клеточных контактов, что является главным отличием таких опухолей от базальноподобных.
До конца года список участников приоритетного проекта «Внедрение дистанционного мониторинга больных хроническими неинфекционными заболеваниями, в том числе профессиональными заболеваниями, с использованием персональных приборов и систем искусственного интеллекта» пополнит еще ряд субъектов. Об этом сообщила руководитель направления по работе с медицинскими организациями и промышленными предприятиями ООО «Дистанционная медицина» (РMT Групп) Ксения Коновалова на пресс-конференции «Здоровье общества в регионах России: опыт, возможности, драйверы» 16 августа.
Проект одобрен межведомственной рабочей группой по разработке и реализации национальной технологической инициативы при президиуме Совета при Президенте РФ по модернизации экономики и инновационному развитию России. Мониторинг распространяется на больных с хроническими заболеваниями: артериальной гипертензией, сахарным диабетом второго типа, ХОБЛ и бронхиальной астмой, а также перенесших острый коронарный синдром, операции на сердце и сосудах.
В настоящее время дистанционный мониторинг больных артериальной гипертензией внедряется в 15 регионах, в том числе в Ленинградской, Псковской, Белгородской и Калужской областях, республиках Башкортостан, Бурятия и Саха (Якутия). «Есть соответствующее письмо Татьяны Яковлевой включать этот проект в территориальные программы здравоохранения. Значительное число регионов сейчас находится в стадии апробации. Пока речь идет только о больных артериальной гипертензией. Со следующего года в проект планируется включение пациентов с бронхиальной астмой и сахарным диабетом», – сказала Ксения Коновалова.
По расчетам экспертов, диспансерному наблюдению, в том числе дистанционному, подлежит не менее 1 тыс. пациентов из 1,7 тыс. официально прикрепленных к одному медицинскому специалисту первичного звена. Стоимость медицинских услуг по дистанционному мониторингу включена в подушевой норматив финансирования амбулаторной медицинской помощи на прикрепившихся лиц и оплачивается из средств ОМС в соответствии с тарифным соглашением.
Расчетные показатели эффективности проекта: увеличение охвата диспансерным наблюдением (с 25 до 75%), уменьшение количества предкризисных состояний (снижение со 100 до 5%); уменьшение количества вызовов скорой и неотложной медицинской помощи и сокращение числа госпитализаций по заболеванию, с осложнением и для реабилитации (на 20%).
Подробнее: https://medvestnik.ru/content/news/Minzdrav-rasshirit-chislo-uchastnikov-proekta-po-distancionnomu-monitoringu-hronicheskih-bolnyh.html
Алкогольная зависимость довольно часто сочетается с другими психическими расстройствами, например, тревожными (27,6 %), расстройствами настроения (23,5 %) и личности (39.5 %), и в таких ситуациях особенно тяжело поддается лечению. А одна из основных проблем терапии алкогольной зависимости — «срывы»: 85 % пациентов рано или поздно возвращается к употреблению алкоголя. Выделяют три основных причины таких срывов: непреодолимое влечение к алкоголю, напоминания об алкоголе во время воздержания и стрессовые ситуации. Занявшись лечением всерьез, последние два фактора можно исключить, а на первый — воздействовать современными методами терапии.
Например, влечение к алкоголю можно подавить путем периодической транскраниальной магнитной стимуляции (пТМС) дорсолатеральной префронтальной коры. При этом повышается высвобождение дофамина в прилежащем ядре (nucleus accumbens) и хвостатом ядре (nucleus caudatus), а также модулируется высвобождение дофамина в передней поясной извилине и орбитофронтальной коре. Однако эффект такой терапии непродолжителен, особенно если учитывать возможную генетическую предрасположенность к алкоголизму, связанную с изменениями в дофаминовых рецепторах 2 и 3 типов. А вот если обеспечить постоянную стимуляцию истощаемой дофаминовой системы, есть шанс добиться стойкого эффекта.
О пациенте
Мужчина 38 лет, в анамнезе не поддающаяся лечению алкогольная зависимость, а также коморбидное тревожное расстройство и агорафобия. До становления алкогольной зависимости пациент употреблял амфетамины и чрезмерно увлекался азартными играми. Принимать алкоголь начал в возрасте 17 лет, чтобы справиться с паническими атаками, по большей части связанными с агорафобией: например, выпивал перед выходом из дома, чтобы подавить тревогу. Постепенно алкоголь стал основным предметом его забот, пациент всегда следил, есть ли дома что-нибудь выпить, на случай, если ему вдруг понадобится спиртное, но от окружающих свою привычку скрывал.
Пытался сам контролировать употребление алкоголя и время от времени задавал себе ограничение: выпивал в день не более 4 банок пива с самым высоким содержанием алкоголя, которое смог найти (10 градусов, в одной банке 500 мл). Когда понял, что самостоятельно справиться с зависимостью не может, обратился сначала в общество Анонимных Алкоголиков, затем консультировался у психолога и лечился у нарколога. Пробовал медитацию, практику осознанности, 10 раз ему подшивали имплант с дисульфирамом (антабусом). Поначалу антабус помогал, но как только имплант извлекали, начинал пить еще больше, чем раньше, в том числе с эпизодами компульсивного потребления алкоголя до потери сознания, когда, очнувшись, он опять начинал пить. Поскольку амбулаторное лечение не помогало, пациент несколько раз госпитализировался в психиатрический стационар, там лечение снова давало эффект, но снова ненадолго. В бельгийскую клинику, где занимаются лечением алкоголизма методами нейромодуляции, он обратился после того как увидел в средствах массовой информации сообщение об успешном лечении алкоголизма с помощью пТМС. На момент обращения он оценил влечение к алкоголю на 9,5 по шкале от 0 — отсутствие влечения до 10 — максимально возможное влечение.
В центре провели следующие исследования:
1) Функциональная магнитно-резонансная томография (фМРТ) для визуализации областей, «ответственных» за влечение к алкоголю; оценивалась их активация (а именно гемодинамическая ответная реакция зависимости уровня кислорода в крови — BOLD) в ответ на изображения, связанные и не связанные с ситуациями употребления спиртного. Таким образом предварительно локализовали «источник» патологической активности, ассоциирующийся с влечением к алкоголю.
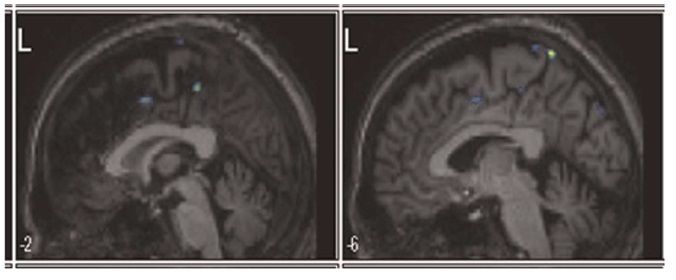
Рисунок 1. На фМРТ в сагиттальной проекции видны участки BOLD-активации в дорсальной части передней поясной извилины/дополнительной моторной области (участок кпереди) и левого предклинья (участок кзади) за месяц до хирургической операции.
2) Результаты фМРТ подтвердили методом электроэнцефалографии совместно со стандартизированной электромагнитной томографией низкого разрешения (sLORETA). Этот метод позволяет обнаружить источник электрической активности, которая при ЭЭГ регистрируется с поверхности черепа. В отличие от фМРТ, это исследование проводится без всякой стимуляции, с закрытыми глазами, все внешние стимулы и артефакты исключаются. Данные пациента сравнили с результатами 15 здоровых мужчин, подобранных по возрасту.
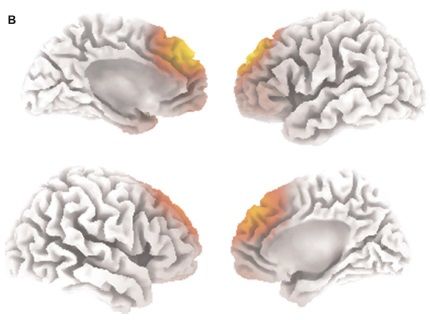
Рисунок 2. ЭЭГ с sLORETA в покое в сравнении с контрольной группой по бета-ритму (12-30 Гц) выявила повышенную спонтанную активность в области передней поясной извилины/дополнительной моторной области с распространением на фронтополярную кору (поле 10 по Бродману) — левое верхнее и правое нижнее изображение, за месяц до хирургической операции.
Лечение
Начать терапию решили с неинвазивной нейромодуляции путем пТМС двойным коническим индуктором, чтобы спрогнозировать, насколько этому пациенту будет полезна имплантация стимулятора.
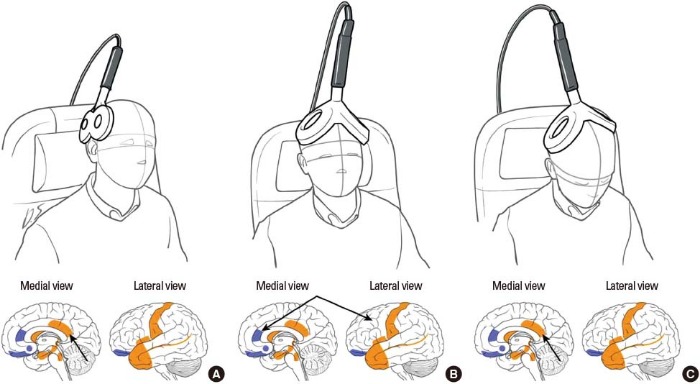
Стимуляция была направлена на область BOLD-активации по данным фМРТ и источник спонтанной активности по данным ЭЭГ-LORETA. Через две недели состояние пациента изменилось кардинально: силу влечения к алкоголю он оценил на 2 балла из 10 (по сравнению с первоначальными 9,5). Но, как ранее говорилось, через 6 недель эффект угас. Пациенту предложили плацебо-сессию, чтобы ни у кого не осталось сомнений в эффективности именно стимуляции, но пациент был так впечатлен результатами ТМС, что отказался от всех проверок и попросил сразу установить стимулятор.
Ход операции
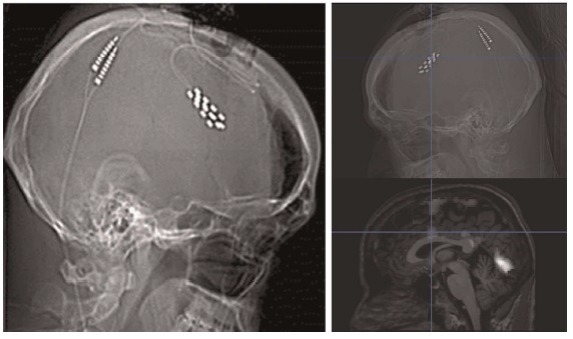
После получения информированного согласия было проведено оперативное вмешательство: малая трепанация в правой лобной области и доступом через серп мозга введение двух электродов для билатеральной стимуляции дорсальной части передней поясной извилины. Нейронавигация осуществлялась с помощью безрамной системы Stealth.
Разрез кожи проводили в лобной области по линии роста волос, пересекая срединную линию. Трепанационное отверстие размером 4х4 см было выполнено прямо над верхним сагиттальным синусом. Твердую мозговую оболочку рассекли U-образным разрезом, обнажив серп мозга, чтобы провести устройство для нейронавигации между правой лобной долей и серпом.
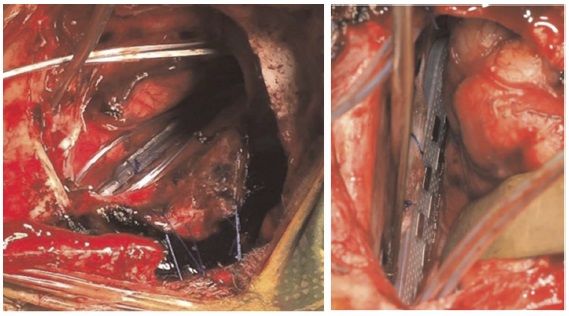
Когда целевой участок был локализован, серп рассекли и поместили электроды — Lamitrode 44, американского производства — свободно в области мозолистого тела, латеральнее околомозолистых артерий. Их соединили задними поверхностями и поместили в области, определенные при фМРТ, так, чтобы они располагалась непосредственно под серединой электродов, чтобы компенсировать возможные погрешности в навигации и интраоперационные смещения.
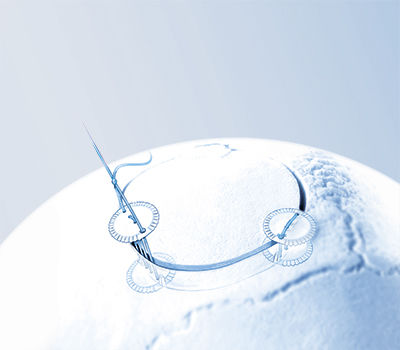
Затем электроды дополнительно подшили к серпу, чтобы предотвратить послеоперационные смещения. После промывания операционной области твердую мозговую оболочку зашили и трепанационное отверстие закрыли с использованием системы Craniofix.
Электроды под кожей провели к теменной области, там присоединили к удлинителю далее вывели на переднюю поверхность грудной клетки, где через второй удлинитель вывели к правой стороне живота и подсоединили к генератору, который будет располагаться в этой области в кожном кармане.

На второй день после операции, когда в очередной раз у пациента появилась тяга к спиртному, электроды активировали, силу тока при стимуляции подобрали так, чтобы появился отчетливый эффект. Коррекции по побочным эффектам не потребовалось, поскольку их просто не было, в том числе симптомов абстиненции, которых врачи ожидали. На пятый день после операции пациент был выписан; влечение к алкоголю на тот момент он оценивал на 4 из 10. На приеме через 1, 3 и 6 месяцев после операции пациент утверждал, что оно снизилось до 1 из 10, вместе с тем исчезли тревожность и симптомы агорафобии.
По словам пациента, теперь он чувствовал себя «внутренне свободным», «будто камень с души свалился». Теперь он мог спокойно отправиться за покупками в торговый центр, где всегда многолюдно. Тяга к алкоголю полностью пропала, и из алкогольного отдела пациент теперь выходил с пустой тележкой, совершенно не испытывая потребности что-то купить. Освободившееся время он мог проводить с женой и дочерью. Через год пациент также бросил курить; симптомы зависимости, агорафобии и тревожности все еще отсутствовали через 18 месяцев после операции.
Вновь выполненная ЭЭГ с LORETA показала, что при выключенных электродах патологические альфа-осцилляции в передней поясной извилине все еще сохранялись, а обычная альфа-активность была по сравнению с результатами до операции, нормальной. Когда после 18 месяцев работы электроды отключили, все аспекты электрической активности в области интереса, кроме дельта-активности, пришли в норму.
Обоснование метода
Алкоголизм и ранее пытались лечить нейрохирургическими методами, например, с помощью цингулотомии и разрушения прилежащего ядра. Эффект был получен очень хороший, но были и нежелательные последствия (снижение устойчивости внимания после цингулотомии), к тому же у обеих операций есть серьезный недостаток: наносимое повреждение необратимо. Затем была предложена глубокая стимуляция прилежащего ядра, она оказалась эффективна у 3 пациентов из 6, перенесших эту процедуру, причем у одного из них была та же клиническая картина, что и у нынешнего пациента: зависимость, агорафобия и тревожность. Стимуляция именно передней поясной извилины с целью избавить пациента от зависимости ранее не проводилась и описывается впервые.
Однако в лечении других заболеваний имплантация электродов в эту область уже применялась, а именно при хронической боли и при эпилепсии, на этот опыт и опирались исследователи. Паттерн стимуляции, который применялся в этом случае, ранее был исследован на животных; он подбирался так, чтобы имитировать залповую активность нейронов, но при этом навязывать необходимый постсинаптический потенциал (возбуждения или торможения). Наибольший тормозный потенциал получали с помощью спайков с частотой 500 Гц, именно этот режим и взяли за основу стимуляции для данного пациента.
Недостаток этого случая, во-первых, в отсутствии плацебо-контроля, однако маловероятно, что эффект плацебо дал бы такое стойкое улучшение у пациента с такими тяжелыми симптомами; а во-вторых, в невозможности судить, насколько этот метод подойдет пациентам, не страдающим тревожностью и агорафобией, которые в какой-то степени послужили причиной зависимости в данном случае.
Подробнее: https://medvestnik.ru/content/news/Minzdrav-vvodit-massovyi-skrining-na-tri-vida-raka.html
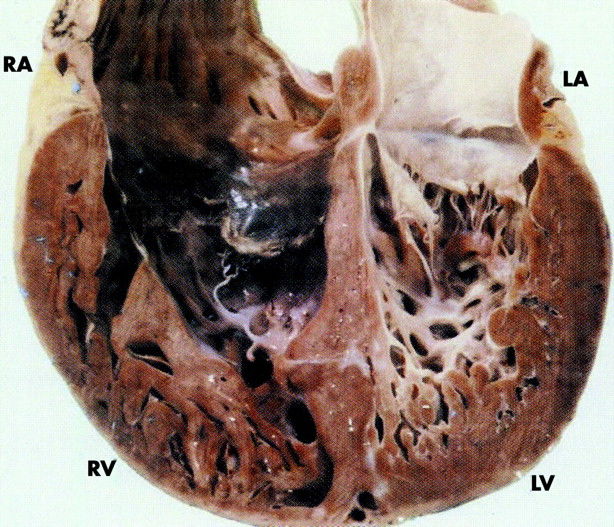
Некомпактный миокард левого желудочка (синонимы: губчатый миокард, эмбриональный миокард, персистирующие синусоиды) — генетически детерминированная кардиомиопатия, которая характеризуется патологической трабекулярностью миокарда левого желудочка в результате нарушения нормального эмбриогенеза сердца с формированием двух слоев миокарда: толстого некомпактного (эндокардиального) и тонкого нормального (компактного, эпикардиального).
Код по МКБ-11
BC44 Noncompaction cardiomyopathy
Историческая справка
Первые упоминания губчатого миокарда описаны американским хирургом Самуэлем Беллетом в 1932 году: в миокарде левого желудочка новорожденного с цианотическим врожденным пороком сердца отмечались глубокие лакуны и трабекулы, выявленные при аутопсии. Далее, лишь с развитием и внедрением эхокардиографии (далее ЭхоКГ), в 1984 году немецкие ученые Рольф Энгбердинг и Франц Бендер описали наличие синусоид миокарда у пациента, характерные лишь для эмбрионального этапа развития сердца. В 1990 году детский кардиолог и американский профессор кафедры педиатрии вместе с соавторами предложил термин «изолированная некомпактность миокарда левого желудочка». Учитывая все большее внедрение в практику ЭхоКГ, описывалось множество случаев данной нозологии, и в 1995 году Всемирная организация здравоохранения включила данное заболевание в группу неклассифицируемых кардиомиопатий. Затем, в 2006 году, Американская ассоциация сердца отнесла данную патологию к первичным генетическим кардиомиопатиям. С 2008 года заболевание включено в группу неклассифицируемых кардиомиопатий согласно классификации Европейского общества кардиологов.
Эпидемиология
Распространенность заболевания среди взрослого населения составляет 0,014%. Встречается: у 0,01-0,27% всех взрослых пациентов, направленных на ЭхоКГ; у 3% больных из 960 с признаками ХСН; у 100 пациентов из 36933, перенесших ЭхоКГ (в период с 1994-2006 гг). По данным разных ученых, заболевание чаще встречается у мужчин (56–82 %). В детской практике из всех случаев кардиомиопатий некомпактный миокард встречается в 9,2%, занимая третье место после гипертрофической КМП и дилатационной КМП.
Эмбриональное развитие миокарда
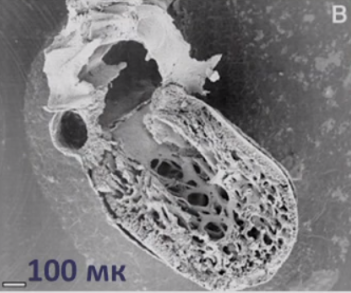
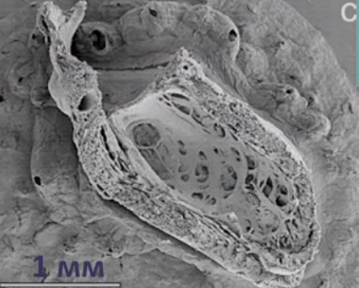
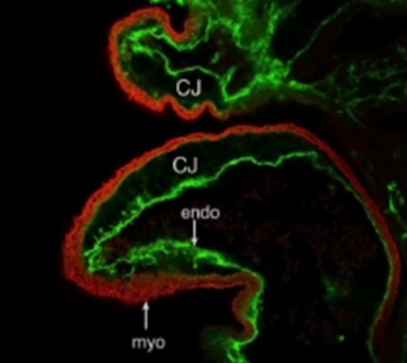
Для наиболее точного понимания механизма образования некомпактного слоя миокарда обратимся к эмбриологии. Миокард развивается из миоэпикардиальной пластинки спланхнотома мезодермы, представляя собой сеть волокон, разделенных широкими полостями. С 5-й недели эмбрионального развития происходит уплотнение сети волокон, сужение межтрабекулярных лакун, формируется коронарный кровоток, происходит процесс уменьшения межтрабекулярных пространств до размеров капилляров. Миокард «компануется» от основания к верхушке, от эпикарда к эндокарду (рис. 1, 2, 3, 4). При нарушении данного процесса, чаще всего в результате генетической мутации в генах, кодирующих белок таффазин, альфадистробеверин, гетерозиготные мутации в генах, кодирующих MYH7, ACTC, TNNT2, в сердце остаются зоны некомпактного миокарда с глубокими межтрабекулярными пространствами.
2009 July 2
Классификация
Большинство ученых выделяют следующие формы некомпактного миокарда:
– изолированный;
– в сочетании с врожденными пороками сердца;
– в сочетании с нейромышечными заболеваниями (метаболическая миопатия, синдром Barth, синдром Roifman, синдром Ohtahara, синдром Noonan, мышечная дистрофия Emery–Dreifuss, мышечная дистрофия Becker, синдром Melnick–Needles).
По форме возникновения:
– спорадическая;
– семейная (30%).
По анатомическим формам выделяют:
– левожелудочковая;
– правожелудочковая;
– бивентрикулярная.
По морфологическим типам:
– лакунарный;
– губчатый;
– смешанный.
По степени некомпактности миокарда (по отношению толщины слоя некомпактного миокарда к толщине всей стенки сердца на уровне верхушки левого желудочка):
– мягкая (0,33–0,26)
– умеренная (0,25–0,20)
– тяжелая (менее 0,2)
Патогенез и клиника
Патогенез складывается из сердечной недостаточности, синдрома нарушений ритма, тромбоэмболического синдрома.
Сердечная недостаточность выходит на ведущее место в клинике данного заболевания. Из-за нарушенной архитектоники строения миокарда происходит нарушение его сократительной способности. При тяжелой степени некомпактности клиническая картина данного синдрома наиболее выражена с преобладанием недостаточности по обоим кругам кровообращения и с выраженным снижением общей сократительной способности миокарда. Как правило, у некоторых пациентов клиника заболевания может манифестировать в результате запуска воспалительного процесса в миокарде, а в ряде случаев, при благоприятном течении, некомпактный миокард можно выявить впервые у лиц пожилого возраста. В клинической картине заболевания на первое место может выходить болевой синдром, который выражается приступами стенокардии. Это объясняется большей потребностью в кислороде некомпактного слоя миокарда, который не кровоснабжается основными ветвями коронарных артерий, а кровоснабжение его происходит непосредственно из полости левого желудочка.
Синдром нарушений ритма проявляется чаще всего желудочковыми нарушениями ритма — более чем в половине случаев (экстрасистолия, нередко и высоких градаций). В четверти случаев наблюдается фибрилляция предсердий. Также, вследствие эндомиокардиального фиброза с захватом проводящей системы сердца наблюдаются нарушения проводимости по типу АВ, СА-блокад.
Конечно же, нарушение глобальной систолической функции, наличие нарушений ритма сердца, а в частности фибрилляции предсердий, наличие глубоких лакун предрасполагает к образованию тромбов в полости левого желудочка, а отсюда и тромбоэмболических осложнений (кардиоэмболические инсульты, ТИА, мезентериальный тромбоз).
Диагностика
Клиника при данном заболевании неспецифична, она может маскировать и дебют ИБС, и прочие кардиомиопатии. В данном случае нам помогает ЭхоКГ и МРТ с контрастированием гадолинием, помимо стандартной ЭКГ и суточного мониторирования ЭКГ.
Выделяют следующие эхокардиографические критерии некомпактного миокарда:
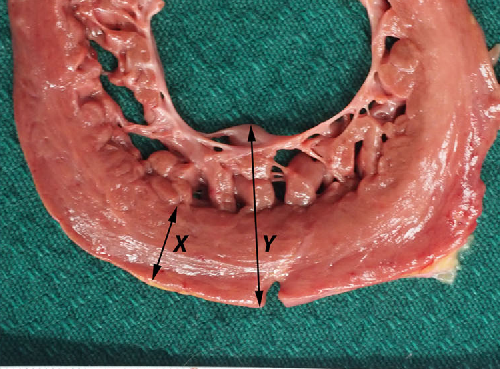
- Критерий Chin, 1990. Отношение компактной (X) части миокарда к общей толще миокарда (Y) ≤ 0,5.(рис.6) Измерение проводится в конце диастолы из парастернальной проекции по короткой оси и верхушечной проекции;
- Критерий Jenni, 2001. Измеряется в конце систолы из парастернальной позиции по короткой оси левого желудочка. Отмечается отношение некомпактной части миокарда к компактной более 2; визуализируются многочисленные выступающие трабекулы с глубокими межтрабекулярными пространствами, между которыми при цветовом доплере выявляется кровоток;
- Критерий Stollberger, 2007. Наличие более 3 трабекул в левом желудочке в направлении от верхушки к папиллярным мышцам, визуализирующиеся одновременно в одной эхокардиографической позиции; выявление кровотока в межтрабекулярных пространствах при цветном доплере;
Так же проводится оценка всех стандартных параметров при ЭхоКГ (размеры полостей, наличие изменений сократительной способности, клапанная недостаточность, оценка фракции выброса).
МРТ проводится с контрастным усилением редкоземельного металла гадолиния, оценивается: ФВ ЛЖ, индексированная масса миокарда (компактного, некомпактного); число некомпактных сегментов; критерий некомпактности (чувствительность 86%, специфичность 99%: соотношение компактного и некомпактного слоя миокарда в диастолу более 1:2); индекс ремоделирования левого желудочка.
И, конечно же, не стоит забывать о генетическом картировании и биопсии миокарда.
Принципы и тактика лечения.
Пациентам с бессимптомным течением специфической терапии не требуется, им нужно лишь динамическое наблюдение у врача кардиолога. При наличии клиники лечение должно складываться из следующих составляющих: стандартная терапия ХСН; назначение антикоагулянтной терапии при необходимости (снижение ФВ, ТЭ в анамнезе, тромбоз полостей сердца); назначение, при необходимости, антиаритмической терапии; назначение иммуносупрессивной терапии при доказанности аутоиммунного повреждения миокарда. Так же, в отдельных случаях, могут рассматриваться варианты установки ЭКС (при наличии блокад высоких градаций с эпизодами синкопе); установки кардиовертера-дефибриллятора (при плохом терапевтическом ответе на антиаритмики); трансплантации сердца.
Несмотря на значительные успехи в развитии акушерской помощи, частота преждевременных родов остается высокой. Данная проблема является не только медицинской, но и социальной, связанной с решением задач по улучшению качества последующей жизни детей, родившихся недоношенными и сопряженными материально-экономическими затратами. Врачебная тактика при преждевременных родах зависит от гестационного срока, клинической картины, целостности плодного пузыря. Она включает в себя, помимо прочего, повышение вероятности рождения жизнеспособного плода (профилактика респираторного дистресс-синдрома плода). С этой целью используются кортикостероиды. Несмотря на их широкое повсеместное применение, в настоящее время нет единого мнения относительно выбора конкретного кортикостероида, дозы, частоты, времени использования и способа введения.
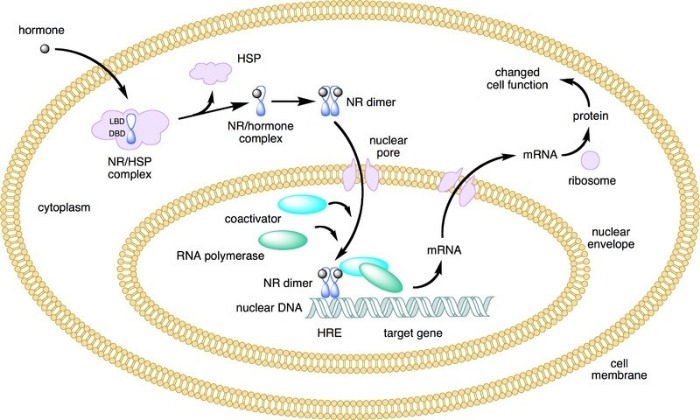
Кортикостероиды действуют внутриклеточно, взаимодействуя со специфическими рецепторами в цитоплазме клеток. При этом рецептор «активируется», что приводит к его конформационным изменениям. Образовавшийся комплекс стероид-рецептор проникает в ядро клетки и, связываясь с ДНК, регулирует транскрипцию определенных генов, благодаря чему происходит стимуляция образования специфических иРНК, которые влияют на синтез белков и ферментов. Все это приводит к глюкокортикоидным эффектам, включая глюконеогенез, протеолиз, липолиз, подавление иммунных реакций и минералокортикоидным эффектам, включая гипертонию, удержание натрия и воды и потерю калия. В фетальном легком действие кортикостероидов приводит к увеличению продуцирования белка, биосинтезу фосфолипидов и появлению сурфактанта.
G. C. Liggins в 1969 году продемонстрировал, что легкие ягнят, рожденных преждевременно, становятся функционально зрелыми после антенатального введения кортикостероидов. Далее следовали несколько клинических испытаний для оценки влияния кортикостероидов у людей с целью ускорения созревания легких плода.
Кокрейновский обзор «Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth» показал, что однократный курс антенатальных кортикостероидов значительно уменьшил частоту респираторного дистресс-синдрома плода (Roberts, 2006). Другими полезными результатами были снижение неонатальной смертности, цереброваскулярных кровоизлияний, некротизирующего энтероколита, инфекционной заболеваемости и потребности в респираторной поддержке и интенсивной терапии новорожденных. Для материнского организма использование кортикостероидов не показало увеличения риска летального исхода, хориоамнионита или послеродового сепсиса (Roberts, 2006). Кортикостероиды стали стандартом для женщин с риском преждевременных родов до 34 недель беременности во многих странах.
В настоящее время в качестве антенатальных кортикостероидов в клинической практике применяются бетаметазон и дексаметазон. Они оба способны проникать через плаценту в их активной форме и иметь сопоставимые свойства. Оба препарата имеют категорию С по FDA, то есть применяются, если ожидаемый эффект терапии превышает потенциальный риск для плода. По результатам 12 крупных рандомизированных исследований было сделано заключение о том, что дексаметазон ассоциируется с более низким риском внутрижелудочкового кровоизлияния, по другим статистически важным показателям, таким как перинатальная смертность и развитие респираторного дистресс-синдрома, значимых различий не наблюдалось.
По способу введения пероральный; в отдельных небольших исследованиях уступал внутримышечному, так как происходило увеличение частоты неонатального сепсиса. Крупных рандомизированных исследований проведено не было.
В режиме дозирования между 12-часовыми и 24-часовыми интервалами никаких различий в материнских или неонатальных исходах не было отмечено. Отдельным плюсом в пользу 12-часового интервала является сокращение пребывания матерей в лечебно-профилактических учреждениях.
В заключение можно сказать, что курсовое применение кортикостероидов безоговорочно улучшает исход преждевременных родов. Дексаметазон имеет некоторые преимущества по сравнению с бетаметазоном в связи с улучшением биофизических показателей, уменьшением количества внутрижелудочковых кровоизлияний и, соответственно, времени пребывания в отделении интенсивной терапии новорожденных. Пока недостаточно данных для создания руководства клинической практикой относительно оптимальных схем приема кортикостероидов, требуются дальнейшие исследования, непосредственно сравнивающие дозу, частоту и отдаленные последствия приема кортикостероидов у женщин с риском преждевременных родов, а также исследование других, возможно, оптимальных, дозировок и режимов приема.
Подробнее: https://medvestnik.ru/content/news/Minzdrav-vvodit-massovyi-skrining-na-tri-vida-raka.html
Синдром Ли-Фраумени (LFS) — это редкий, доминантно-наследуемый синдром предрасположенности к раку, который был впервые описан в 1969 году. В большинстве семей он вызван гаметными мутациями в гене TP53 и характеризуется ранней манифестацией множественных специфических видов рака и очень высокой продолжительностью риска развития рака. Несмотря на значительный прогресс в понимании молекулярной биологии гена TP53, оптимальное клиническое лечение этого синдрома еще не подобрано.
Открытие. LFS был впервые описан в 1969 году докторами Фредериком Ли и Джозефом Фраумени-младшим в докладе о семьях с разнообразными ранне-манифестирующими заболеваниями раком, включая детские саркомы и рак молочной железы у молодых людей. LFS имеет аутосомно-доминантный тип наследования с тенденцией к множественным первичным видам рака. Хотя саркомы костей и мягких тканей, рак молочной железы, адренокортикальная карцинома, опухоли головного мозга и лейкемия остаются признаками LFS, последующие исследования показали, что спектр развивающихся форм рака более генетически разнообразен и включает рак легких, прямой кишки, желудка, простаты, яичника, поджелудочной железы, а также лимфомы, меланомы и карциномы сосудистого сплетения. Кроме того, Ли-Фраумени-подобный синдром (LFL — Li-Fraumeni Like) аналогичен LFS, но определяется менее строгими классификационными критериями, следовательно семьи с синдромом LFL имеют более низкую распространенность мутаций TP53; мутация гена TP53 может быть идентифицирована в 70% семейств LFS, в тоже время только в 20–40% семьях с синдромом LFL идентифицируется данная мутация.
Ген ТР53. Ген TP53 был найден в локусе 17p13.1 17-ой хромосомы в 1986 году и впоследствии определен в качестве основной причины LFS. Наиболее вредные гаметные мутации происходят в доменах связывания ДНК, и соматические мутации гена TP53 часто идентифицируются в различных типах рака. Белок р53 играет важную роль в различных клеточных процессах, включая остановку роста, апоптоз или усиленную репарацию ДНК в ответ на повреждение и множественные формы клеточного стресса, а также в регулировании имплантации эмбриона и репродуктивной способности. Кроме того, связь между белком р53, митохондриальным дыханием и регуляцией клеточного цикла может быть вычислена (29e31), поскольку она может дать представление о механизмах, через которые мутации гена ТР53 могут способствовать развитию опухоли. Вариабельность пути белка р53 и относительная редкость LFS сделали поиск различных типов рака и возраста манифестации у пациентов с гаметными мутациями гена TP53 настоящим соревнованием. Однонуклеотидные полиморфизмы (SNP) в генах TP53 и MDM2, интегральный компонент функции белка p53, по-видимому, влияют на возраст манифестации рака в LFS. Короткие теломеры также были связаны с более ранним началом первого случая заболевания раком у индивида. Уровень генетической нестабильности, измеряемый геномной вариацией числа копий (CNV-copy number variations), выше у лиц с гаметными мутациями гена TP53, чем у здоровых пациентов, и повышенный у носителей мутаций с раком в анамнезе. В настоящее время нет никаких инструментов для прогнозирования рака у отдельного человека с LFS: какой тип рака возникнет и в каком возрасте манифестирует. Таким образом, объединяя информацию, полученную из специфической мутации гена TP53, выбранного набора генетических маркеров (например, MDM2 SNP 309; дупликация PIN3 в гене ТР53) и мер генетической нестабильности (например, длина теломера, частота CNV), стало возможным деление людей с LFS на низкие, средние, высокие группы риска, с рекомендациями по скринингу на основе уровня риска.

Классические критерии LFS
■ Пробанд c саркомой, диагностируемой до 45 лет, и ближайший родственник с раком, диагностированным в возрасте 45 лет, и родственник первой или второй степени родства с любым раком с началом в возрасте 45 лет или саркомой в любом возрасте.
Критерий синдрома LFL (Birch)
■ Пробанд с любым детским раком, саркомой, опухолью головного мозга или АКК с манифестацией в возрасте до 45 лет, и родственник первой или второй степени родства с основным видом рака LFS (саркома, рак молочной железы, опухоль головного мозга, АКК или лейкемия) с манифестацией в любом возрасте, и родственник первой или второй степени родства с любым раком с началом до 60 лет.
Критерий синдрома LFL (Eeles)
■ Два человека первой или второй степени родства с основной злокачественной опухолью LFS (саркома, предменопаузальный рак молочной железы, опухоль головного мозга, АКК, лейкемия или бронхоальвеолярный рак легких) в любом возрасте.
Критерий Chompret для генетического анализа гена ТР53
■ Пробанд с однократной опухолью LFS (саркома, предменопаузальный рак молочной железы, опухоль головного мозга, АКК, лейкемия или рак легкого [бронхоальвеолярный]) в возрасте 46 лет, и по крайней мере один родственник первой или второй степени родства с основной опухолью LFS (кроме рака молочной железы, если у пробанда есть рак молочной железы) с манифестацией в возрасте 56 лет или с множественными опухолями
■ ИЛИ пробанд с множественными опухолями (за исключением множественного рака молочной железы), две из которых являются основными опухолями LFS, причем впервые диагностирована в возрасте 46 лет
■ ИЛИ пробанд, диагностированный с карциномой АКК или сосудистого сплетения, независимо от семейной истории.

■ УЗИ брюшной полости каждые 3–4 месяца от рождения до 10 лет
Рак молочной железы
■ Тренировка и обучение в самообследовании груди с 18 лет
■ Клиническое исследование груди каждые 6–12 месяцев, начиная с 20–25 лет
■ Ежегодная МРТ молочной железы, начиная с 20–25 лет до 50 лет
■ Обсуждение двусторонней мастэктомии, уменьшающей риск
Опухоль мозга
■ МРТ мозга, которая должна быть включена в ежегодный МРТ-анализ всего тела
■ Ежегодная неврологическая экспертиза
■ Ежегодная МРТ всего тела
■ Ежегодный комплексный медицинский осмотр
Гематопоэтический рак
■ Ежегодный полный анализ крови с 18-летнего возраста
■ Колоноскопии 5 раз в год, увеличение на 2–5 раз в год от 25 лет или, в случаях известной семейной историей этого заболевания, с возраста предшествующего самой ранней манифестации минус 10 лет
■ Необходимо дать полную информацию о риске, связанном с колоноскопией
Рак желудка
■ Эндоскопия 5 раз в год с полным объяснением риска эндоскопии, увеличение
на 2–5 раз в год от 25 лет или, в случаях с известной семейной историей
этого заболевания
Клинический случай.
Пациент Б., 19 лет (1991 г. р.), впервые был госпитализирован в ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН в ноябре 2006 г. в 15-летнем возрасте с диагнозом остеосаркома нижней трети левой бедренной кости. Диагноз верифицирован путем открытой биопсии. Проведено комбинированное лечение, которое на первом этапе включало 4 курса неоадъювантной полихимиотерапии по схеме: доксорубицин + цисплатин (с 30.11.06 по 17.02.07), на втором — хирургическое пособие в объеме резекции дистального отдела левой бедренной кости с замещением дефекта эндопротезом коленного сустава (13.03.07). При гистологическом исследовании удаленной опухоли отмечены признаки лечебного патоморфоза III степени, в краях резекции элементов опухоли не найдено.
В адъювантном режиме с 27.03.07 больной получил с чередованием 3 курса полихимиотерапии по схеме: доксорубицин + циклофосфан + цисплатин и 3 курса по схеме: ифосфамид с эквивалентным количеством уромитексана + этопозид. При очередном контрольном обследовании в апреле 2009 г. выявлено объемное образование в правом надпочечнике, первично расцененное как метастаз остеосаркомы. В связи с этим больному было проведено 3 курса полихимиотерапии по схеме: ифосфамид + этопозид + карбоплатин (с 06.09 по 08.09), на фоне которой появились признаки хронической почечной недостаточности. На следующем этапе выполнена лапароскопическая адреналэктомия справа. По результатам планового гистологического исследования диагностирован адренокортикальный рак. В марте 2010 г. у пациента появились жалобы на головную боль, тошноту, рвоту и шаткость при ходьбе. При МРТ головного мозга с контрастированием визуализировано объемное образование округлой формы с нечеткими контурами, размерами 3,0 × 2,9 см, кистозно-солидной структуры в области червя мозжечка с вентральным распространением в IV желудочек, на фоне окклюзионной гидроцефалии, вновь предварительно расцененный как метастаз остеосаркомы. 31.03.10 больному выполнено хирургическое вмешательство в объеме удаления опухоли червя мозжечка с наружным вентрикулярным дренированием переднего рога бокового желудочка. При плановом морфологическом исследовании операционного материала констатировано разрастание медуллобластомы GIV преимущественно «классического» варианта строения. На следующем этапе (05.05.10—10.06.10) проведена лучевая терапия на головной и спинной мозг (СОД 34 Гр + локально на область задней черепной ямки разовая очаговая доза 2 Гр, СОД 54 Гр). Химиотерапия больному не проводилась ввиду наличия почечной недостаточности. При контрольном комплексном обследовании в октябре 2010 г. данных, подтверждающих прогрессирование заболевания, не получено. Ухудшение состояния пациента произошло в январе 2011 г., когда появились грубый нижний парапарез и нарушение функции тазовых органов. При МРТ головного и спинного мозга с контрастированием обнаружено метастатическое поражение продолговатого мозга, спинного мозга, мозговых оболочек. Пациент умер 27.02.11 от прогрессирования основного заболевания.
Семейный анамнез пациента, за исключением деда по отцовской линии, умершего от рака желудка в возрасте 70 лет, не отягощен. С учетом «классического» варианта развития ПМЗН, характерных для СЛФ, пациенту было проведено молекулярно-генетическое обследование в объеме определения первичной структуры кодирующей части гена ТР53 (3–11-й экзон) для исключения/подтверждения наследственной этиологии заболевания с использованием методов полимеразной цепной реакции, конформационно-чувствительного электрофореза и секвенирования.
При исследовании ДНК, выделенной из лимфоцитов периферической крови, выявлены наследуемые герминальная миссенс-мутация G245S (p.Gly245Ser; c.733G/A) в 7-м экзоне гена ТР53 в гетерозиготном состоянии и полиморфные варианты в 4-м экзоне — R72P и 3-м интроне — Int3dup16 в гетерозиготном состоянии. Выявленные структурные перестройки зарегистрированы в международной базе данных IARC. Для молекулярно-генетического анализа опухоли были доступны только образцы операционного материала медуллобластомы. При исследовании ДНК, выделенной из срезов с парафиновых блоков опухоли с использованием метода прямого секвенирования, выявлен аллельный дисбаланс (потеря гетерозиготности) в 7-м локусе экзона гена ТР53 с потерей аллеля «дикого» типа, что приводит к полной инактивации функций гена ТР53, подтверждая развитие опухоли по классическому механизму наследственного канцерогенеза.