Новости
Ежедневно во всем мире от сахарного диабета второго типа и вызванных им заболеваний умирает 8 700 человек. Вдумайтесь: ведь это 10 человек каждую минуту! Такие цифры скорее характеры для эпидемии, не правда ли? Однако в основном причиной смерти пациентов является не сам диабет, а болезни сердца. Так не стоит ли поставить знак равенства между диабетом и ССЗ?
Болезнь или эпидемия?
По данным ВОЗ, сахарным диабетом болеет 8,5 процентов населения Земли. В 90 процентах случаев – это сахарный диабет второго типа. В России официально зарегистрировано 4,3 миллиона больных диабетом, но на самом деле их гораздо больше. По оценкам, этим эндокринным заболеванием страдает от 8 до 10 миллионов россиян. Расхождение в цифрах имеет простое объяснение – диабет очень долго может протекать в скрытой форме, и человек, который на самом деле уже больной, «на бумаге» еще таковым не является.
По темпам прироста смертность от осложнений сахарного диабета опережает туберкулез, СПИД и многие другие болезни. При этом сахарный диабет не является инфекционным заболеванием, и сам по себе к смерти не приводит. За него это делают осложнения, и в первую очередь – сердечно-сосудистые заболевания. Именно из-за болезней сердца – инфаркта, ишемической болезни сердца, сердечной недостаточности – уходят из жизни 80 процентов пациентов с диабетом.
По оценкам эндокринологов, риску заболеть сахарным диабетом подвержены 20 процентов россиян. Самая лучшая профилактика очень проста – это здоровый образ жизни. Но если болезнь уже пришла, то единственный вариант избежать серьезных проблем – не доводить до осложнений. Для этого требуется своевременная постановка диагноза, приверженность лечению, доверие врачу, изменение образа жизни.
Диабет – сердечно-сосудистое заболевание
«Когда-то считалось, что сахарный диабет – это легкое заболевание, но потом пришло осознание, что это не так, – говорит заведующий кафедрой эндокринологии ФГБОУ ДПО РМАНПО Минздрава РФ Александр Аметов. – Сахарный диабет и его осложнения – одна из ключевых причин смертности в мире. 14,5 процентов от общей смертности в возрасте 20-79 лет приходится на сахарный диабет. Почему, выигрывая отдельные сражения, говоря, как мы хорошо научились снижать сахар, мы глобально проигрываем войну тяжелому хроническому и пока неизлечимому заболеванию... Сейчас для нас как специалистов главная цель лечения пациентов – не просто снижение сахара, а увеличение продолжительности жизни. Но без тесного сотрудничества с другими специалистами снизить смертность от сахарного диабета вряд ли получится».
Сахарный диабет серьезно уменьшает ожидаемую продолжительность жизни – в среднем на 12 лет. У таких пациентов риск возникновения сердечно-сосудистых заболеваний в два раза выше, чем у людей, сравнимых с ними по полу, возрасту, привычкам, образу жизни... Соответственно, выше и смертность от кардиологических осложнений. Поэтому ученые уже не раз ставили вопрос о том, чтобы приравнять эту болезнь к сердечно-сосудистым заболеваниям.
«Столь высокая степень взаимосвязи этих заболеваний – сердечно-сосудистых и сахарного диабета – делает абсолютно необходимым развитие плотного междисциплинарного взаимодействия кардиологов и эндокринологов при ведении таких пациентов», – подчеркивает профессор кафедры кардиологии ФГБОУ ДПО РМАНПО Минздрава РФ Игорь Жиров.
Почему при сахарном диабете происходят именно сердечно-сосудистые осложнения? Причины этого, как говорят кардиологи, в длительной повреждающей активности избыточного содержания глюкозы. Глюкозотоксичность очень опасна для эндотелия сосудов почек, сердца, головного мозга. В местах повреждений запускаются патологические процессы, в частности, происходит атеросклеротическое поражение сосудов сердца.
«При сахарном диабете избыточное содержание глюкозы – это удобрение для роста атеросклеротического процесса, – поясняет Игорь Жиров. – Прогрессирование происходит в 2–3 раза быстрее. У больных без диабета атеросклеротический процесс происходит в крупных артериях, и на эти случаи есть масса способов лечения. У больных с сахарным диабетом поражение артерий происходит практически на всех уровнях, в том числе и в самых мелких сосудах. Такие пациенты требуют длительной методичной и агрессивной профилактики и лечения. И крайне важно, чтобы пациент понимал, что в данном случае борьба с заболеванием и осложнениями – это не спринтерский забег, а марафон».
Профилактика диабета
Как и многие другие заболевания, сахарный диабет и его осложнения проще предупредить, чем лечить. Что приводит к болезни? Знакомые, увы, многим факторы риска: неправильное питание, гиподинамия, избыточное потребление алкоголя, стрессы, эмоциональное перенапряжение вкупе с определенными генетическими особенностями.
Но большинство людей, зная об этих факторах и отдавая себе отчет в том, какой вред они несут, обращаются к врачу, когда уже даже не первые звоночки прозвенели, а развилось вполне серьезное недомогание. 60 процентов всех обращений в поликлинику происходит уже, когда требуется лечение. Между тем, если человек придет на этапе формирования факторов риска развития диабета, то вполне возможно предотвратить болезнь!
«Не так сложно организовать профилактику, как привлечь людей, – говорит главный внештатный специалист по профилактической медицине департамента здравоохранения г. Москвы Нана Погосова. – Необходимо сделать так, чтобы ситуация изменилась, чтобы основной процент обращений в поликлинику был по поводу профилактики, а не по поводу уже возникших жалоб. До болезни можно и не доводить. Сейчас в Москве действует одна из мощнейших профилактически программ – диспансеризация населения. В 2017 году диспансеризацию в столице прошло около двух миллионов человек! Это немало, но останавливаться на этом нельзя. Важно заложить в сознание людей идею о том, что профилактика – это кратчайший путь к улучшению здоровья, за которое каждый из нас несет персональную ответственность».
При осмотре полости рта пациента на стоматологическом приёме врач может заметить меланому крайне редкой локализации (0,2‒8 % от всех меланом, и только небольшая их часть описана в литературе). Чаще всего она появляется на десне, покрывающей альвеолярный отросток верхней челюсти или нёбе. Существует несколько свидетельств появления данной опухоли в области нижней челюсти (а также на щеках, дне полости рта, языке, губах). В отличие от кожных меланом, меланома полости рта чаще определяется у мужчин. Опухоль биологически активна и очень агрессивна, чаще своих кожных «коллег» приводит к летальным исходам: пятилетняя выживаемость составляет всего 15‒38 %. Зачастую меланома данной локализации остаётся недиагностирована до тех пор, пока не начнёт проявляться клинически.
Меланома — злокачественная опухоль, возникающая из-за нелетальных генетических мутаций в пигментных клетках — меланоцитах. Вырабатывая пигмент, меланоциты защищают генетический аппарат от повреждающего воздействия экзогенных факторов (например, УФ-лучей). Природная смуглость кожи, бронзовый загар, родинки и веснушки — всё это результат активной продукции меланина пигментными клетками, располагающимися в базальном слое эпидермиса.
При прохождении курса гистологии все мы узнаём удивительный факт: меланоциты находятся не только в составе кожи, но и присутствуют в полости рта (а также в среднем слое сосудистой оболочки глаза, внутреннем ухе, эпителии влагалища, менингеальных оболочках, чёрной субстанции и голубом пятне мозга, костях и сердце). С точки зрения защиты от солнечных лучей подобную локализацию объяснить затруднительно, но если изучить функции меланоцитов более подробно, то можно попробовать разобраться в таком странном на первый взгляд местоположении. В рамках этого поста мы рассмотрим только меланоциты слизистой оболочки полости рта (СОПР).
Изначально отличительной особенностью предшественников меланоцитов является их повышенная склонность к миграции. Благодаря сложным и пока мало изученным молекулярным механизмам, эти клетки способны мигрировать не только по направлению книзу от нервного жёлоба, но и в другие стороны, благодаря чему в процессе развития и дифференцировки они могут стать представителями различных групп клеток (например, нейронами и клетками глии). После дифференцировки меланоцит занимает своё место в базальном слое эпидермиса (или в собственной пластинке СОПР), уходя отростками в шиповатый слой. В полости рта меланоциты могут не вырабатывать меланин, но как и у их кожных “коллег”, объём вырабатываемого меланина генетически детерминирован и зависит от расовой принадлежности.
Меланин может окрашивать СОПР как неравномерно, так и однородно, чаще всего проявляя себя в виде пигментаций на десне. Несмотря на различные предположения, причину возникновения меланомы в полости рта до сих пор не удалось выявить, известны лишь некоторые внутриклеточные молекулярные сигнальные пути. Ни постоянное травмирование, ни хроническое воспаление, ни вирус папилломы человека, ни курение не показали какой-либо статистической значимости в развитии данной патологии. Единственным фактором риска является наличие гиперпигментации. Известно, что около 30 % меланом полости рта возникают на месте гиперпигментаций, однако происхождение гиперпигментированных премеланом до сих пор остаётся загадкой.
Функция меланоцитов в полости рта также на сегодняшний день точно не определена. Очевидно, что они отвечают за цвет СОПР и защищают от таких стрессорных факторов, как УФ-излучение, активные формы кислорода (АФК) и свободные радикалы. Меланины также обладают способностью “отбирать” ионы металлов для связывания некоторых лекарств и органических молекул. В связи с тем, что синтез меланина — кислородзависимый процесс, в меланосомах происходит выработка и накопление АФК, что приводит к повреждению ДНК. УФ-излучение, в свою очередь, приводит к увеличению образования свободных радикалов во время синтеза меланина, в частности, феомеланина (жёлто-красный пигмент). Таким образом, меланин обладает одновременно и детоксицирующими, и АФК-зависимыми цитотоксическими свойствами.
Благодаря наличию лизосомальных ферментов (α-маннозидаза, кислая фосфатаза и др.) в меланосомах, меланин способен нейтрализовать бактериальные ферменты и токсины, а используя свою высокую связывающую способность, он может служить физическим барьером для микроорганизмов. Также меланоциты способны выполнять роль антигенпредставляющих клеток (АПК), стимулировать Т-клеточную пролиферацию, фагоцитировать микроорганизмы, а также ингибировать рост бактерий и грибковых микроорганизмов.
Таким образом, можно сделать вывод, что с эволюционной точки зрения меланин необходим не только для окрашивания кожи, её придатков и слизистых оболочек, но и для защиты организма. Меланоциты кожи (и, возможно, СОПР) экспрессируют гены, кодирующие кортикотропин-релизинг фактор, проопиомеланокортин, адренокортикотропный гормон, β-эндорфины, α-меланоцит-стимулирующий гормон и рецептор меланокортина-1. Все вышеперчисленные участники меланокортиновой системы способны нейтрализовать внешние патогены, опосредовать антимикробный и иммунный ответы и местную ноцицепцию.
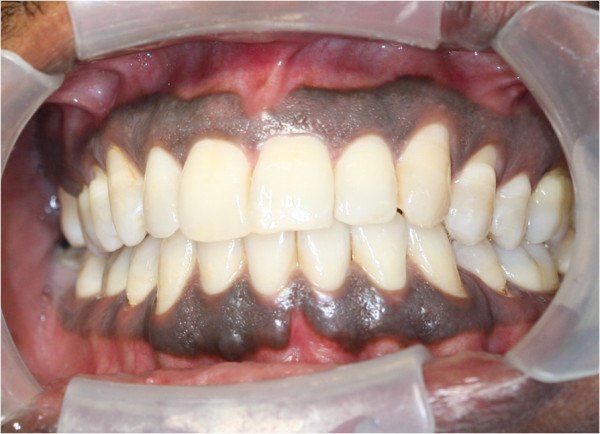
Как было сказано выше, единственным доказанным фактором риска является наличие гиперпигментации. Необходимо различать физиологическую и патологическую пигментацию СОПР. Их следует дифференцировать от болезни Аддисона, нейрофиброматоза, меланотического пятна, меланомы СОПР, пигментации, вызванной приёмом лекарств, саркомы Капоши, сосудистой мальформации и гемангиомы полости рта. Физиологическая пигментация в равной степени встречается и у мужчин, и у женщин, бессимптомна, локализуется чаще всего билатерально на слизистой оболочке десны в виде одиночных или сгруппированных коричневых пятен с чёткими границами.
Злокачественный вариант пигментации — меланома — развивается в результате трансформации и клональной экспансии меланоцитов, локализующихся либо в базальном слое эпидермиса, либо в собственной пластинке СОПР. Пятилетняя выживаемость составляет всего 32 %. Согласно различным источникам, ахроматические формы меланом составляют от 2 % до 40 %.
Клинически меланома СОПР обычно безболезненна, представляет из себя пятна или папулы неправильной формы коричневого или чёрного цвета, которые могут увеличиваться в размере, перерастать в узлы или экзофитные массы и становиться более пигментированными. На поздних стадиях очаги могут становится болезненными, изъязвлёнными и склонными к кровоточивости, пигментация неравномерной, с вкраплениями серых, тёмно-синих, коричневых и чёрных цветов. Примерно у 25 % пациентов с меланомой СОПР на момент обращения к врачу уже есть метастазы в регионарные лимфатические узлы, а у 10 % наблюдается гематогенная диссеминация в лёгкие, печень, кости и мозг. Клетки меланомы СОПР экспрессируют маркёры MART-1/Melan-A, HMB-45, MITF, тирозиназу и белок S-100.
При обнаружении меланомы СОПР в первую очередь необходимо установить, является ли она первичной или же метастатической. В том случае, если меланома первичная, необходимо оценить объём инвазии и поражение регионарных лимфоузлов. Наиболее распространённая система классификации для стадирования меланом — TNM.
При диагностировании данных очагов in situ заболевание является излечимым и прогноз чаще всего положительный, но в связи с бессимптомным течением данная меланома обнаруживается уже на поздних стадиях, что делает прогноз заболевания крайне отрицательным.
Хирургическое иссечение является основным методом при лечении меланомы. Однако более 50 % хирургических операций не предотвращают рост и метастазирование опухоли и не повышают выживаемость, так же как и химиотерапия. Послеоперационный контроль можно осуществлять с помощью новых методов лучевой терапии. Также есть данные об эффективности иммуностимулирующих и цитотоксических препаратов. Ингибиторы внутриклеточных молекулярных сигнальных путей (например, cKit) используются в качестве таргетной терапии, однако ответ на лечение незначительный, что связывают со сложностью молекулярных взаимодействий, участвующих в патогенезе данного заболевания.
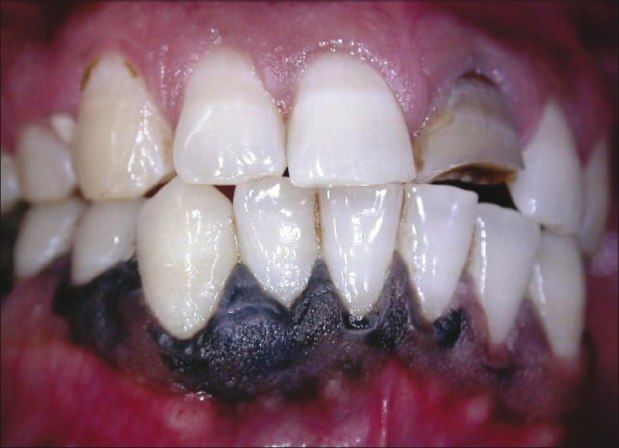
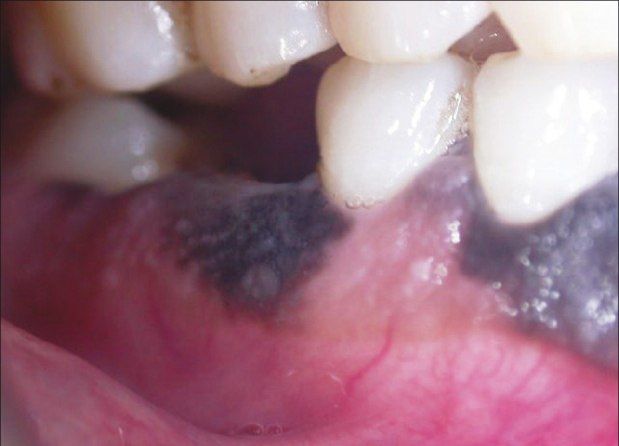
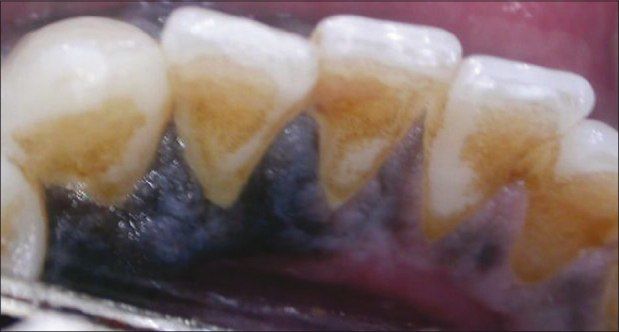
Мужчина, 42 года, обратился к врачу с жалобами на тёмные участки дёсен в области фронтальной группы зубов нижней челюсти. Пигментация наблюдалась с вестибулярной и язычной сторон в области резцов и клыка, а также в области 46 зуба (см. фото). Повышенная пигментация не была связана с какими-либо другими симптомами, пациент жаловался лишь на эстетический дефект. Два года назад заметил два небольших участка гиперпигментации, с тех пор участки увеличились в размерах. Пациент отрицал курение, употребление жевательного табака и алкоголя, семейный анамнез по данному заболеванию отсутствовал. При пальпации образование не было твёрдым, лимфоузлы не пальпировались. Анализ крови был в норме, на рентгенограмме не было никаких значительных изменений. Инцизионная биопсия помогла поставить диагноз «меланома полости рта». Пациент был направлен в ЧЛХ, терапия была начата немедленно, но в связи с высокой степенью злокачественности пациент скончался спустя 4 месяца после её начала.
С 2000 по 2015 год частота родоразрешения путем кесарева сечения возросла с 12 до 21% по всему миру. Как показало исследование, в бедных странах данная операция все еще недоступна большинству женщин, тогда как в развитых странах врачи ее проводят слишком часто, пишет Reuters.
В исследовании использовались данные ВОЗ, собранные в 169 странах мира. Оказалось, что ежегодно частота проведения кесарева сечения возрастает на 3,7%. Наибольшей популярностью операция пользуется в странах Северной Америки, Западной Европы и Латинской Америки, а также на Карибских островах.
Авторы работы выявили 15 стран, в которых более 40% детей рождаются путем кесарева сечения, лидером в этом списке оказалась Доминиканская Республика с показателем 58,1%. По подсчетам ученых, по медицинским показаниям кесарево сечение требуется в 10-15% случаев родоразрешения.
В ходе заседания правления Российского союза промышленников и предпринимателей 10 октября 2018 года Министр здравоохранения России Вероника Скворцова подписала Хартию в поддержку Всероссийского движения по сохранению здоровья человека «Здоровье 360°».
Целью Движения является консолидация усилий государств, бизнеса, органов государственной власти, профсоюзов и ученых по развитию современных и эффективных подходов, направленных на сохранение жизни и здоровья населения трудоспособного возраста.
Присоединившись к Хартии, Минздрав России поддержал изложенные в ней инициативы по повышению внимания к сохранению здоровья работающего населения и со своей стороны будет способствовать реализации корпоративных программ по охране здоровья работников, нацеленных, в том числе и на профилактику хронических неинфекционных заболеваний, являющихся основными причинами смертности в трудоспособном возрасте.
Министр отметила, что забота о здоровье работника – это не просто формальная обязанность работодателя, но и долговременные инвестиции в трудовые ресурсы с высокой экономической отдачей и основа благополучного существования его предприятия в будущем.
«Организация различных медицинских оздоровительных мероприятий, нацеленных на формирование у работника приверженности к ведению здорового образа жизни, с привлечением всех заинтересованных сторон станет залогом не только увеличения производительности труда, но и уменьшения экономической нагрузки на бизнес», – добавила Министр.
Минздрав России продолжает уделять особое внимание вопросам охраны труда и проведению регулярных профилактических осмотров и мероприятий, направленных на формирование позитивного отношения к здоровью.
Выездная бригада, специализирующаяся на помощи паллиативным пациентам, появилась при медсанчасти №1 Томска; медики работают с понедельника по пятницу с 13.00 до 17.00, сообщает во вторник пресс-служба обладминистрации.
"В Томской области появилась выездная бригада паллиативной помощи. Бригада работает при медико-санитарной части №1 Томска. Медики выезжают к паллиативным пациентам на дом, консультируют, назначают и корректируют лечение, проводят процедуры", – говорится в сообщении.
Уточняется, что в состав бригады входят врач и медицинская сестра. При необходимости вместе с бригадой к паллиативным пациентам могут выезжать узкие специалисты – хирурги, онкологи, психотерапевты.
"Специалисты (паллиативной бригады) выезжают по обращению врачей, пациентов или их родственников, график работы бригады — с понедельника по пятницу с 13 до 17 часов", – цитирует пресс-служба главного врача медсанчасти №1 Татьяну Данченко.
По данным открытых источников, паллиативная помощь – это подход, обеспечивающий улучшение качества жизни пациентов в терминальной стадии развития смертельных заболеваний. Паллиативная медицина, в частности, обеспечивает уход за неизлечимыми больными (хосписы), а также решение проблемы доступности для них сильнодействующих обезболивающих препаратов
В г. Ростов-на-Дону 5 октября 2018 года прошла 1-я научно-практическая конференция с международным участием «Актуальные вопросы экстренной и неотложной медицинской помощи в практике врача скорой медицинской помощи и терапевта». Её организаторами являются Российское общество скорой медицинской помощи, Минздрав Ростовской области, ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ, ФГБОУ ВО «ПСПбГМУ им.И.П.Павлова» МЗ РФ, ФГБОУ ВО «СЗГМУ им.И.И.Мечникова» МЗ РФ.
Конференция прошла под председательством Левицкой Н.А., к.э.н., начальника управления здравоохранения г. Ростов-на-Дону, Миннуллина И.П., д.м.н., профессора, директора Института сестринского образования, Мирошниченко А.Г., д.м.н., профессора, заведующего кафедрой скорой медицинской помощи ФГБОУ ВО «СЗГМУ им.И.И.Мечникова» МЗ РФ, Тараканова А.В., д.м.н., профессора, заведующего кафедрой скорой медицинской помощи с курсом военной и экстремальной медицины ВПК и ППС ФГБОУ ВО РостГМУ МЗ РФ. В конференции приняли участие более трёхсот человек – научные сотрудники и преподаватели университетов, докторанты, аспиранты, врачи-специалисты практического звена и др. Среди участников было много гостей из г.Москвы и г.Санкт-Петербурга.
Луганскую Народную Республику на данном мероприятии представляли сотрудники ГУ ЛНР «Луганский республиканский Центр экстренной медицинской помощи и медицины катастроф»: врио директора Пархомчук Д.С., заместитель директора по медицинской работе Бондаренко Л.А., заведующий подстанцией № 1 Волков Е.С., врач-кардиолог СКБ Клименко А.И., врач-реаниматолог АРБ Симонович А.П.
На конференции рассматривались перспективы развития скорой медицинской помощи в современных условиях, организация медицинской эвакуации, неотложная помощь в поликлинических условиях. Привлекла внимание тема инновационных технологий оказания помощи, оснащения и оборудования догоспитального и стационарного этапов скорой медицинской помощи. Обсуждались вопросы подготовки выпускников медицинских вузов к оказанию скорой медицинской помощи в экстренной и неотложной формах, а также тема аккредитации как новой формы допуска специалистов скорой медицинской помощи к профессиональной деятельности. Интерес вызвала информация о волонтёрском движении на базе городских станций скорой медицинской помощи.
Среди выступавших на пленарном заседании был руководитель Центра Пархомчук Д.С. Тема его выступления – «Опыт работы бригад скорой медицинской помощи в условиях активных боевых действий». В нём были затронуты вопросы, касающиеся организации и оказания скорой помощи населению Республики в осложнённой чрезвычайной ситуации – во время боевых действий, в условиях кадрового дефицита и нехватки медикаментов и изделий медицинского назначения. Озвучены проблемные моменты, выявленные в службе скорой помощи в результате активных боевых действий 2014-2015г.г. Представлен обобщающий материал о создании единого центра экстренной и неотложной медицинской помощи, который объединяет скорую помощь и медицину катастроф.
По итогам конференции был издан сборник научных материалов и трудов, подготовленных специалистами медицинских организаций, образовательных и научных учреждений, работающих в сфере оказания скорой медицинской помощи населению. Необходимо отметить, что авторами и соавторами восьми публикаций в нем являются специалисты Центра – Пархомчук Д.С., Бондаренко Л.А., Гавриленко Н.Ф., Хаврель А.А., Оберемок С.Е., Лактионова Т.С., Адитатова А.В., Удовика Н.А., Манищенков С.Н., Алёшина Р.М., Бережков Б.Я., Логинов А.В., Стоянова О.А., Бондарь В.К., Вовняченко Д.А., Ковтонюк И.А., Солёная И.Б. и др.
В период проведения конференции была организована выставка современных образцов медицинского и учебного оборудования, а также лекарственных препаратов, использующихся в практике скорой медицинской помощи на догоспитальном и стационарном этапах, терапевтической помощи.
Разнообразие тем докладов, выступления и презентации, активное общение с представителями и ведущими специалистами Министерства здравоохранения РФ, Академии наук РФ, крупнейших вузов, а также с коллегами из многих регионов России – все это в целом представляет большой интерес и может быть использовано в практической деятельности врачами различных специальностей, в том числе и экстренной и неотложной медицинской помощи.
Мероприятия подобного уровня способствуют налаживанию долгосрочного сотрудничества как в научной, так и в практической сфере
45% автопарка работает более пяти лет и требует замены
В России около половины автопарка скорой помощи нуждается в замене, рассказали «Известиям» в Минздраве. Порядка 45% машин служат уже более пяти лет. В рекомендациях фонда ОМС по эксплуатации автомобилей «скорой» сказано, что существенный износ происходит уже после трех лет работы кареты, а после пяти — машину нужно заменять.
Как пояснили «Известиям» в пресс-службе Минздрава, самый большой износ — 70% — у автомобилей «скорой» класса А (в них не оказывается медпомощь во время транспортировки). Среди машин класса B (основной тип) изношены 36%, а среди реанимобилей — 44%.
Как сообщал главный внештатный специалист Минздрава по скорой медицинской помощи Сергей Багненко, по итогам 2017 года только треть автопарка скорой эксплуатировалась меньше трех лет — 6,4 тыс. машин. 5,5 тыс. автомобилей работали менее пяти лет, а 8,8 тыс. — более пяти лет.
Изношенность определяется исходя из срока эксплуатации машин. В рекомендациях Фонда обязательного медицинского страхования о скорой помощи в системе ОМС сказано, что не следует использовать авто старше пяти лет. При этом существенный износ происходит уже после трех лет работы.
По данным, представленным на официальном сайте государственных закупок, в среднем одна машина без оборудования стоит от 1,5 млн рублей, с оборудованием — 2–2,5 млн рублей. Получается, государству нужно найти в бюджете около 20 млрд рублей на обновление автопарка «скорой» (8,8 тыс. машин, служащих более пяти лет).
Как рассказали «Известиям» в Агентстве стратегических инициатив (АСИ), согласно постановлению правительства России, в 2018 году за счет федерального и регионального бюджетов будет закуплено 895 автомобилей скорой медицинской помощи. Это лишь 4,3% от автопарка. Однако в год требуется обновлять по 4 тыс. машин, подсчитали в АСИ.
Регионы могут выйти из проблемной ситуации, используя аутсорсинг, когда бизнес закупает машины, оборудует их, нанимает водителей, организует процесс работы 24 часа в сутки и предоставляет их станции скорой помощи как услугу. Договор заключается через процедуру госзакупок.
Практика государственно-частного партнерства в здравоохранении — очень перспективное направление, уверен губернатор Пермского края Максим Решетников.
— Пермский край уже 10 лет применяет этот подход при закупке услуг скорой помощи. Автопарк Пермской станции скорой помощи комплектуется автотранспортом на принципе аутсорсинга. Это позволяет рационально использовать бюджетные средства, поскольку оптимизируются расходы на приобретение автопарка, поддержание его в рабочем состоянии, оплату труда водителей. Мы в таком случае платим только за конкретную работу: выезд машины на вызов, а не за ее простой, — рассказал он.
Аутсорсинг — не аксиома, но это практика, которая действует в 15–20 регионах России, добавил руководитель проекта «Новоскор» Евгений Фридман.
Однако система аутсорсинга реализуема не во всех субъектах, полагает директор НИИ организации здравоохранения и медицинского менеджмента Давид Мелик-Гусейнов.
— Нужно в любом случае планово заменять изношенный автопарк, причем на отечественные автомобили. Они дешевле. Менять нужно ежегодно не менее 5–10%. При этом также стоит тщательно следить за состоянием действующего автопарка, проводить полноценное техобслуживание, использовать качественный бензин и масло. Тогда машины прослужат дольше, — считает он.
Кроме того, ситуацию улучшит модернизация работы диспетчерской службы, отметил Давид Мелик-Гусейнов. Необходимо организовать сортировку входящих сообщений так, чтобы бригады выезжали только тогда, когда их помощь действительно необходима, пояснил он.
Качество автомобиля крайне важно для пациента, отметил председатель независимого профсоюза работников скорой помощи «Фельдшер.ру» Дмитрий Беляков.