Новости
Во всех регионах, независимо от сегодняшнего уровня дефицита, к 2021 г. обеспеченность первичного звена кадрами (врачами и средним медперсоналом) будет доведена до 95%. Об этом сообщила министр здравоохранения России Вероника Скворцова на встрече с членами Совета Федерации в рамках «Открытого диалога с министром».
Для реализации проекта по кадровому обеспечению дефицит специалистов с высшим и средним образованием определен по специальным расчетным формулам. Для каждого региона создана линейка полного устранения дефицита до 2024 г.
Для достижения указанных показателей был проанализирован выпуск во всех 46 медицинских вузах системы Минздрава, 40 медицинских факультетах системы Минобрнауки и двух классических университетах в Москве и Санкт-Петербурге. «Мы знаем линейки выпусков, сколько человек, куда и как должны передвигаться в этой системе. У нас очень большой ресурс, у нас нет проблем с устранением дефицита даже с тем учетом, что ежегодно 8–10% специалистов уходят на пенсию. Мы это тоже все учли», – отметила министр.
Министр подчеркнула сложность кадрового проекта, поскольку он касается не закупок, а живых людей. Специалистам должны предоставить жилье с возможностью дальнейшей приватизации, компенсировать оплату коммунальных услуг в течение 3–7 лет, дать служебные автомобили для объезда ФАП и сельских амбулаторий. Для этого должны быть приняты соответствующие законодательные акты на региональном уровне. В качестве удачного примера министр привела опыт Сахалина.
Вероника Скворцова упомянула роль программ «Земский доктор» и «Земский фельдшер» в решении кадровых проблем. Молодые специалисты, приезжающие не только в сельскую местность, но и в рабочие поселки, поселки городского типа, а с этого года и в города с населением менее 50 тыс. человек, получают единовременно 1 млн руб. (врачи) и 500 тыс. руб. (фельдшеры). Министр отметила также, что для учащихся в вузах по целевому набору определено время отработки – не менее трех лет, и по результатам 2017 г. уже 90% целевиков отрабатывают эти годы на том месте, для которого их готовили.
Подробнее: https://medvestnik.ru/content/news/Veronika-Skvorcova-k-2021-godu-obespechennost-pervichnogo-zvena-kadrami-dovedut-do-95.html
Аспиранты Донского государственного технического университета Максим Белойванов и Иссам Самара разработали систему, способную бесконтактно определять пульс и частоту дыхания человека посредством веб-камеры, сообщает пресс-служба вуза.
Замер производится при помощи камеры, подключенной к компьютеру или телефону. Человека для этого нужно расположить на расстоянии не более 1,5 метра от камеры так, чтобы он мог сохранить неподвижность в течение 30 секунд. Частота дыхания определяется за счет еле заметных колебаний головы, которые камера улавливает и передает на вычисляющее устройство.
Определение пульса происходит более сложным методом. "Важно понимать, что в камере нет никакого лазера, в момент считывания параметров ведется обычная съемка. Наш метод основан на фотоплетизмографии", – цитируются в сообщении слова Белойванова.
Он пояснил, что в моменты сокращения сердечной мышцы сосуды лица наполняются кровью. За счет этого изменяется спектр отраженного от лица света, который измеряется с помощью камеры
Разработанную технологию можно использовать на любом устройстве, снабженном веб-камерой. Применять ее можно в медицине, когда возникают трудности при определении физиологических параметров пациента – например, при сильных ожогах.
В настоящее время на рынке представлены аналогичные устройства, однако работают они в разы медленней. Уникальность же данной разработки заключается в использовании более точных методов фильтрации сигнала отраженного от лица света и собственных методах предварительной обработки изображения.
Аспиранты также работают над технологией определения артериального давления, планируя создать многофункциональное специализированное устройство и подать свою разработку на патент РФ.
Данное состояние описывалось под разными названиями, например: синдром изоляции, синдром деэфферентации, псевдокома. Термин «синдром запертого человека» (locked-in syndrome / LIS) был введен в 1966 году в публикации Plum and Posner [1]. Однако впервые довольно точно данное состояние было описано в художественной литературе еще в XIX веке. В романе 1846 года «Граф Монте-Кристо» Александр Дюма (отец) описывает своего героя, господина Нуартье де Вильфор, как «трупа с живыми глазами»: «зрение и слух были единственными чувствами, которые, подобно двум искрам, еще тлели в этом теле, … да и то из этих двух чувств только одно могло свидетельствовать о внутренней жизни, еще теплившейся в этом истукане — взгляд. В черных глазах старого Нуартье … сосредоточилась вся энергия, вся воля, вся сила, весь разум, некогда оживлявшие его тело и дух. Конечно, недоставало жеста руки, звука голоса, движений тела, но этот властный взор заменял все. Глаза отдавали приказания, глаза благодарили».
В 1868 году Эмиля Золя в романе «Тереза Ракен» описал прогрессирующую форму синдрома запертого человека: у госпожи Ракен «только глаза и были в движении; они стремительно вращались в глазницах, зато щеки, губы как бы окаменели, их неподвижность наводила ужас. Несомненно, она все видела, слышала и рассуждала трезво и ясно, но она не могла пошевелить ни одним членом: лишенная голоса, она не могла передать вовне мысли, рождавшиеся в ее сознании. Тереза … довольно ловко общалась с замурованным сознанием старухи, еще живым, но погребенным в недрах мертвого тела».
В 1875 году французский врач M. Darolles дал одно из первых точных описаний клиники и патологии случая «запертого человека» [2]. У его пациента — женщины старше 30 лет, — развилось состояние, при котором она не могла говорить, но сознание оставалось сохранным. У нее наблюдалась прогрессирующая надъядерная квадриплегия с децеребрационной ригидностью, неспособностью говорить и глотать. Контакт с пациенткой был установлен благодаря сохранным вертикальным движениям глаз, при горизонтальном парезе взора. Состояние пациентки развилось за несколько часов перед смертью. Патологоанатомическое исследование выявило односторонний инфаркт моста мозга, размером с «лесной орех», из-за полной окклюзии базилярной артерии тромбом.
Что такое синдром запертого человека?
Синдром запертого человека — редкое неврологическое расстройство, которое характеризуется полным параличом всех мышц, за исключением мышц, контролирующих движения глаз. Пациенты с синдромом запертого человека не могут произвольно жевать, глотать, дышать, говорить или совершать любые движения мышцами. Под контролем пациента могут оставаться только мышцы, контролирующие движения глаз и век, при этом возможны только вертикальные движения глазами (вверх-вниз), но не горизонтальные (из стороны в сторону). Сохраняется сознание и ориентировка в месте, времени и собственной личности, нормальные циклы сна и бодрствования также сохранны. Таким образом, пациенты с синдромом запертого человека находятся в сознании, но не имеют возможности двигаться (кроме глаз) и говорить.
Когнитивные функции относительно сохранны, у некоторых наблюдаются нарушения памяти и внимания. Пациенты понимают обращенную к ним речь, однако коммуникация возможна только с помощью движений глаз или мигания. В острой/инициальной фазе синдрома коммуникация с пациентом при помощи движений глаз и оценка его когнитивного статуса затруднены, так как уровень бодрствования/сознания колеблется, пациент легко истощаем, движения глаз могут быть плохо контролируемыми и непоследовательными.
Люди с такими поражениями часто находятся в коме в течение нескольких дней или недель, нуждаются в искусственной вентиляции легких, а затем постепенно приходят в сознание, но остаются парализованными и неспособными говорить, внешне напоминающими пациентов в вегетативном состоянии.
Синдром запертого человека вызван повреждением моста — частью ствола мозга, который содержит нервные волокна, которые передают информацию в другие области мозга.
Симптомы / клиническая картина
- Тетраплегия (квадриплегия).
- Анартрия.
- Сохранность сознания и большинства (или всех) когнитивных функций: восприятие, мышление, внимание, память и др. (уровень сохранности функций зависит от размеров очага поражения).
- Сознательное управление движениями век и вертикальными движениями глазных яблок.
- Возможность контакта с пациентом при помощи движений глаз.
Причины
Наиболее частая причина синдрома запертого человека — двусторонние обширные повреждения моста головного мозга (части ствола мозга). Мост содержит важные двигательные тракты: нисходящие кортикоспинальные и кортиконуклеарные пути. При синдроме запертого человека происходит повреждение моторных волокон и двигательных центров в стволе мозга, обеспечивающих контроль мышц лица и речь.
Таблица 1. Причины и механизмы развития синдрома запертого человека.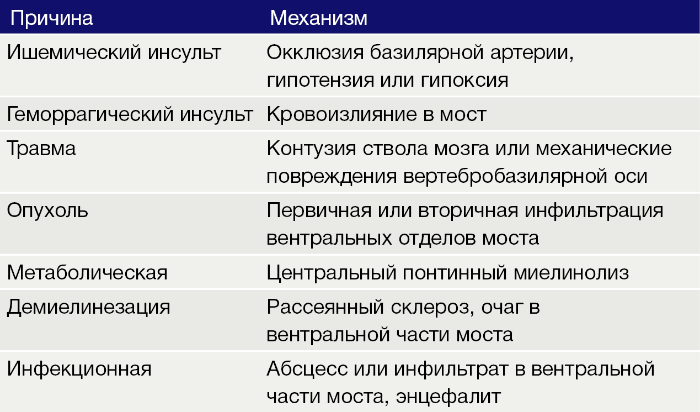
Диагностика
Синдром запертого человека — сложное для диагностики состояние. Исследование 44 случаев синдрома выявило, что в среднем медикам необходимо до 3 месяцев для постановки точного диагноза. Основная сложность при диагностике заключается в том, что большинство пациентов находятся в коме продолжительное время, потом постепенно приходят в сознание, оставаясь парализованными. Поэтому часто первыми, кто замечает реакцию пациента на внешние стимулы, являются его близкие.
Если у пациента в коме, не отвечающего на внешние раздражители, на МРТ выявлено поражение вентральной части моста, необходимо дополнительная диагностика возможности совершать вертикальные движения глаз.
ЭЭГ при синдроме запертого человека выявляет нормальную активность коры и сохранные циклы сна и бодрствования.
Для исключения повреждений мышц и периферических нервов можно использовать электронейромиографию.
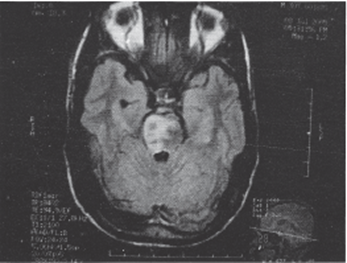 Рисунок 1. T2 Flair МРТ снимок, демонстрирующий билатеральный инфаркт моста (затронувший правую сторону больше, чем левую) (Paliwal et al., 2007)
Рисунок 1. T2 Flair МРТ снимок, демонстрирующий билатеральный инфаркт моста (затронувший правую сторону больше, чем левую) (Paliwal et al., 2007)
Похожие заболевания / дифференциальная диагностика
Симптомы некоторых других заболеваний могут быть схожи с проявлениями синдрома запертого человека. Дифференциальный диагноз данных состояний может представлять определенные трудности.
Акинетический мутизм — редкое неврологическое состояние, при котором пациент не двигается (акинезия) и не говорит (мутизм), находясь при этом в сознании. У пациентов с акинетическим мутизмом сохраняются нормальные циклы сна и бодрствования. Акинетический мутизм — это разновидность «бодрствующей комы» (апаллический синдром), которая развивается из-за повреждений коры лобной доли, таламуса или поясной коры.
Вегетативное состояние — неврологическое состояние, характеризующееся нарушением функции полушарий при нормальном функционировании диэнцефальной области и ствола. В отличие от синдрома запертого человека, у пациента в вегетативном состоянии при сохранности вегетативных функций (обеспечиваемых диэнцефальным отделом и стволом) отсутствуют нормальная корковая активность, регистрируемая на ЭЭГ, и любые осознанные реакции на внешние раздражители.
Некоторые другие заболевания могут иметь клиническую картину, схожую с синдромом запертого человека, например: сидром Гиена-Барре, миастения гравис, полиомиелит, полиневрит.
Классификация
Согласно классификации Bauer et al. выделяют три клинические формы синдрома запертого человека на основе сохранности произвольных движений [3]:
- Неполная форма (incomplete form), при которой некоторые произвольные движения, помимо движений глаз, сохранны.
- Чистая форма (pure form) при которой у пациента отсутствует возможность совершать произвольные движения, за исключением моргания и вертикальных движений глаз.
- Полная/тотальная форма (total form), при которой пациент полностью теряет способность двигаться. Данное состояние наиболее драматично сказывается на психологическом состоянии пациента и его качестве жизни, так как он совершенно не способен взаимодействовать с людьми, сообщать о своих потребностях, выражать свои мысли.
Лечение
Лечение в первую очередь должно быть направлено на причину. Например, при удалении тромба из базилярной артерии и восстановлении нормального церебрального кровотока в течение 6 часов после закупорки возможно полное восстановление моторных и когнитивных функций.
Пациенты с синдромом запертого человека часто нуждаются в искусственной вентиляции легких. Также нормальный прием пищи через рот невозможен, так как попадание частиц пищи в легкие может вызвать респираторную инфекцию, поэтому данным пациентам может быть показана гастростомия.
Важно установить канал коммуникации с пациентом при помощи движений глаз. Медицинские работники и близкие пациента должны определить наиболее простой и удобный для пациента «код» — движение глазами, — и впоследствии все люди, контактирующие с пациентом, должны придерживаться единой системы кодировки. Например, «посмотри вверх» — «да» и «посмотри вниз» — «нет». В таком случае общение ограничено ответами на закрытые вопросы «да-нет», поэтому впоследствии система должна быть модифицирована для кодирования отдельных букв. Например, медицинский работник медленно называет буквы алфавита, пациент должен посмотреть вниз или закрыть глаза, чтобы выбрать букву. Для упрощения можно предъявлять буквы соответственно частоте их встречаемости в языке или использовать таблицы с буквами, организованные в колонки согласно их частотности в языке.
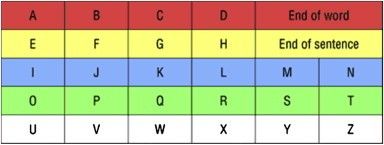
Рисунок 2. AEIOU-алфавит. Ассистент называет цвета, а пациент выбирает нужный ряд движением или миганием. Затем ассистент зачитывает буквы, пациент выбирает нужную букву, которая записывается на доске. Так последовательно формируются слова и предложения. Пример для английского алфавита.
В настоящее время разрабатываются устройства для коммуникации с пациентами с синдромом запертого человека на основе ай-трекинга [Отслеживания движений глаз. — прим. ред.] и компьютерных технологий. Например, сочетание технологий ай-трекинга и генерации компьютерного голоса позволяет пациентам обрести возможность говорить и взаимодействовать со средой.
Важное направление реабилитации — раннее восстановление произвольных движений (чаще движение одним пальцем или ступней, глотание). Исследование показало, что электромиостимуляция может быть эффективна в восстановлении мышечных функций у данной группы пациентов.
Качество жизни
Несмотря на то, что синдром запертого человека — наиболее драматичная форма расстройства моторики, некоторые исследователи отмечают, что качество их жизни несколько выше, чем можно ожидать в данном состоянии. В недавнем исследовании самооценки качества жизни пациентов с хроническим синдромом запертого человека было выявлено, что многие пациенты оценивают свою жизнь как счастливую и наполненную смыслом, особенно когда пациентам доступны адекватные средства для коммуникации с окружающими людьми.
Прогноз
В таблице представлены результаты двух исследований, оценивающих продолжительность жизни пациентов с синдромом запертого человека, и процент пациентов, восстановивших некоторые моторные функции [4, 5].
Таблица 2. Прогнозы жизни пациентов с синдромом запертого человека.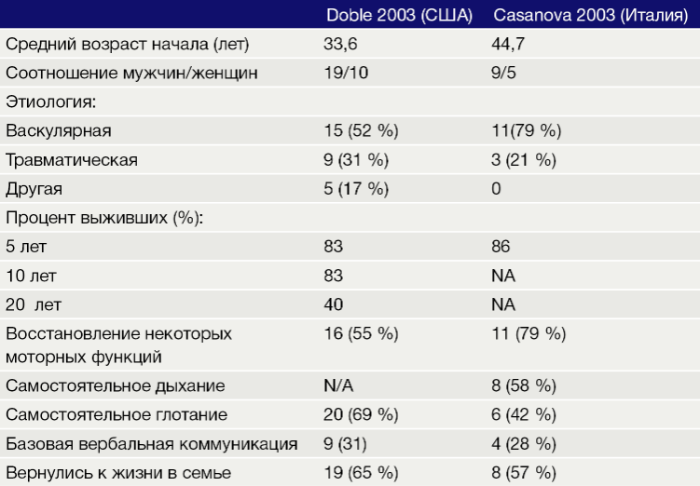
Синдром запертого человека в литературе, фильмах
Jean-Dominique Bauby «The Diving Bell and the Butterfly: A Memoir of Life in Death». И фильм по этой книге: «Скафандр и бабочка» («Le scaphandre et le papillon»).
Нехватку врачей и среднего медицинского персонала планируется устранить на 95% во всех регионах до 2021 года в рамках нацпроекта "Здравоохранение", заявила министр здравоохранения России Вероника Скворцова.
Она пояснила, что в ведомстве при помощи специальных формул изучили, сколько специалистов с высшим и средним образованием не хватает.
"Для каждого региона сделали линейку устранения дефицита до 2024 года. Прерогатива для всех — это устранение дефицита до уровня обеспечения 95% за ближайшие три года к 2021 году. Это будет сделано во всех регионах, вне зависимости от того, какой дефицит сейчас", — сказала Скворцова на рабочей встрече с членами Совета Федерации.
Она отметила, что для достижения этой цели проанализировали данные о выпускниках медицинских вузов и сделали выводы, сколько человек и куда должны поехать работать.
"Конечно, для того, чтобы закреплять специалистов там, где они нужны, это требует серьезных дополнительных мер. Основной государственной мерой является целевая подготовка, которая сейчас уже составляет 55% при обучении в вузе, в некоторых вузах — до 80% от всех бюджетных мест. Отдельная тема — это ординатура, чтобы решить тему с бесплатной ординатурой, мы заложили (увеличение. — Прим. ред.) в два раза числа мест в ординатуру, с 12 тысяч до 24 тысяч в течение ближайших двух лет", — добавила Скворцова.
Нацпроект "Здравоохранение"
Национальный проект "Здравоохранение" содержит восемь направлений развития отрасли, включая совершенствование оказания первичной медицинской помощи, помощи при сердечно-сосудистых и онкологических заболеваниях, развитие медицинской помощи детям, подготовку специалистов-медиков, цифровизацию здравоохранения, развитие национальных медицинских центров и медицинского туризма.
На реализацию проекта выделяется 1,36 триллиона рублей. Скворцова уточняла, что самым затратным окажется направление онкологии, так как планируется внедрение новых клинических рекомендаций и ядерной медицины. В целом выделенные средства будут направлены на строительство и ремонт медучреждений, их переоснащение, а также обучение и переподготовку медиков и внедрение цифровых технологий.
осгвардейцы задержали в Нижнем Новгороде мужчину, который напал на работников скорой помощи с пистолетом, сообщает пресс-служба управления Росгвардии по Нижегородской области.
кипаж вневедомственной охраны управления Росгвардии по Нижегородской области получил информацию о том, что неизвестный мужчина напал на бригаду скорой помощи с предметом, похожим на пистолет, ночью 14 ноября.
"Подъезжая к месту происшествия, младший сержант Илья Астахов и старший сержант Александр Семагин заметили мужчину со следами крови на руках и одежде, внешность которого подходила под описание правонарушителя. На обращение росгвардейцев он ответил агрессией, после чего был задержан. При осмотре прилегающей территории экипаж вневедомственной охраны обнаружил пистолет, который впоследствии был изъят прибывшими полицейскими и идентифицирован как пневматический. Ранее не судимый 31-летний житель Нижнего Новгорода передан в полицию", — говорится в сообщении.
В 2017 году управлением вневедомственной охраны Росгвардии по Нижегородской области было подписано соглашение с руководством станции скорой помощи Нижнего Новгорода, чтобы защитить врачей от агрессивных пациентов.
"Описанный факт пресечения росгвардейцами нападения на медиков после получения тревожного сигнала стал вторым за этот год. Сотрудничество подразделений вневедомственной охраны Нижнего Новгорода и "службы 03", длящееся уже полтора года, привело к значительному сокращению нападений на персонал скорой медицинской помощи", — подчеркивается в сообщении.
Ключевые моменты:
- Работа в ночное время нарушает циркадный ритм и может привести к нарастающему недосыпанию, а также ухудшению работоспособности и здоровья
- Полная адаптация циркадных ритмов к работе в ночную смену невозможна за короткий срок
- Работающие в ночную смену должны помнить о снижении работоспособности и производительности при выполнении трудных задач и по пути домой
Источники и критерии выбора
Авторы выбрали опубликованное руководство по сну и посменной работе из Национального института здравоохранения и совершенствования медицинской помощи Великобритании (National Institute for Health and Care Excellence, NICE) и Королевских колледжей врачей и анестезиологов. Затем в базах данных PubMed и Cochrane (по состоянию на май 2017 г.) авторы провели поиск результатов наблюдательных и рандомизированных контролируемых исследований, мета-анализов, а также систематических и описательных обзоров, изучавших влияние работы в ночную смену на состояние здоровья. Также авторы провели поиск информации по каждому способу, предлагаемому для регуляции сна и бодрствования (приведены в Табл. 1). Предпочтение отдавалось рандомизированным контролируемым испытаниям и мета-анализам, но, учитывая междисциплинарный характер исследований сна и работы в ночную смену, а также качество доказательной базы, авторы дополнительно рассмотрели обсервационные исследования и не индексированные в базах данных публикации из области авиации и тяжелой промышленности, а также опубликованные мнения экспертов.
Работа в ночную смену приходится на период цикла сон-бодрствование («циркадную фазу»), предназначенный для сна. Концентрация внимания, когнитивные функции, психомоторная координация и настроение достигают своего минимума между 3 и 5 часами утра [1]. Трудящимся в ночную смену приходится отдыхать во время циркадной фазы, менее благоприятной для сна [2], что обуславливает усталость и может привести к хроническому нарушению сна [3]. В одном из последних систематических обзоров была показано, что работа в ночную смену повышает риск бессонницы, несчастных случаев на производстве, ожирения и набора веса, сахарного диабета 2 типа, ишемической болезни сердца, а также рака молочной железы, предстательной железы и колоректального рака [4]. В 2017 году при опросе 2231 британских анестезиологов-стажеров более 70 % указали, что усталость влияет на их физическое и психологическое благополучие. 57 % попадали в аварии или предаварийные ситуации при возвращении домой после ночной смены [5].
Эффективность работы в ночную смену с возрастом снижается, а время восстановления увеличивается [6, 7]. Это важно учитывать в госпиталях, стремящихся обеспечивать круглосуточную консультативную поддержку. Ответственность за поддержание здоровья и работоспособности сотрудников несут как организация, так и ее работники, однако целью этой статьи является описание способов, с помощью которых отдельный человек сможет управлять своим режимом сна.
Доказательная база режимов сна, предлагаемых работающим в ночную смену
Два последних Кокрейновских обзора режимов сна, предлагаемых работающим в ночную смену, выявили нехватку достаточно мощных рандомизированных контрольных испытаний с хорошим дизайном, а также преимущественно низкое качество полученной доказательной базы [7, 8]. Сон и работоспособность это сложные, плохо поддающиеся измерению и контролю явления, и маловероятно, что один конкретный способ регуляции сна будет действовать как панацея. В силу указанных ограничений наиболее эффективный подход к борьбе с негативными последствиями работы в ночную смену, скорее всего, будет персонализированным и многофакторным. Учитывая сложность проблемы, авторы предлагают работающим в ночную смену самостоятельно разрабатывать подходящий режим сна и подбирать способы его регуляции среди доказавших свою эффективность экспериментально (в идеале — в рандомизированных контролируемых испытаниях). В этом обзоре авторы представляют стратегии, доказавшие свою эффективность в клинических исследованиях, а также приводят мнения экспертов.
Возможности регуляции сна
Минимизировать недосыпание перед ночной сменой
Во время первой ночной смены работник испытывает как «гомеостатические стимулы» (нарастающую потребность во сне) так и «циркадные стимулы» (нормальный цикл сна и бодрствования), побуждающие ко сну [1]. Продолжительность, время и структура сна у различных людей варьируются: ретроспективное исследование более одного миллиона человек в возрасте от 30 до 102 лет показало, что большинству людей достаточно восьмичасового сна (52 % спали менее 7,5 часов и 4 % менее 6,5 часов в сутки) [10]. Также наблюдались различия по восприимчивости к депривации сна [11]. Работоспособность нарушается, когда человек спит на два часа меньше, чем ему необходимо, а при нарастающем недосыпании работоспособность ухудшается все сильнее [12]. Таким образом, логичным первым шагом будет стремление минимизировать недосыпание до начала ночных смен, позволить себе выспаться (не выставлять будильник) в ночь перед первой ночной сменой и увеличить общее время сна за счет дневного сна (считается, что из-за особенностей циркадных ритмов время между 14 и 18 часами, известное, как «циркадный провал», лучше всего подходит для дневного сна). В рандомизированном контролируемом исследовании 53 человек, работавших в ночную смену, кратковременный дневной сон (за которым следовал прием кофеина) уменьшал объективные и субъективные показатели сонливости в ночную смену по сравнению с контролем [13]. В лабораторном исследовании было показано, что продолжительность дневного сна в 60–90 минут позволяла завершить как медленноволновую фазу сна, так и фазу быстрого движения глаз. Также в условиях исследования кратковременный дневной сон давал определенные когнитивные преимущества, однако этот подход еще предстоит проверить на практике [14].
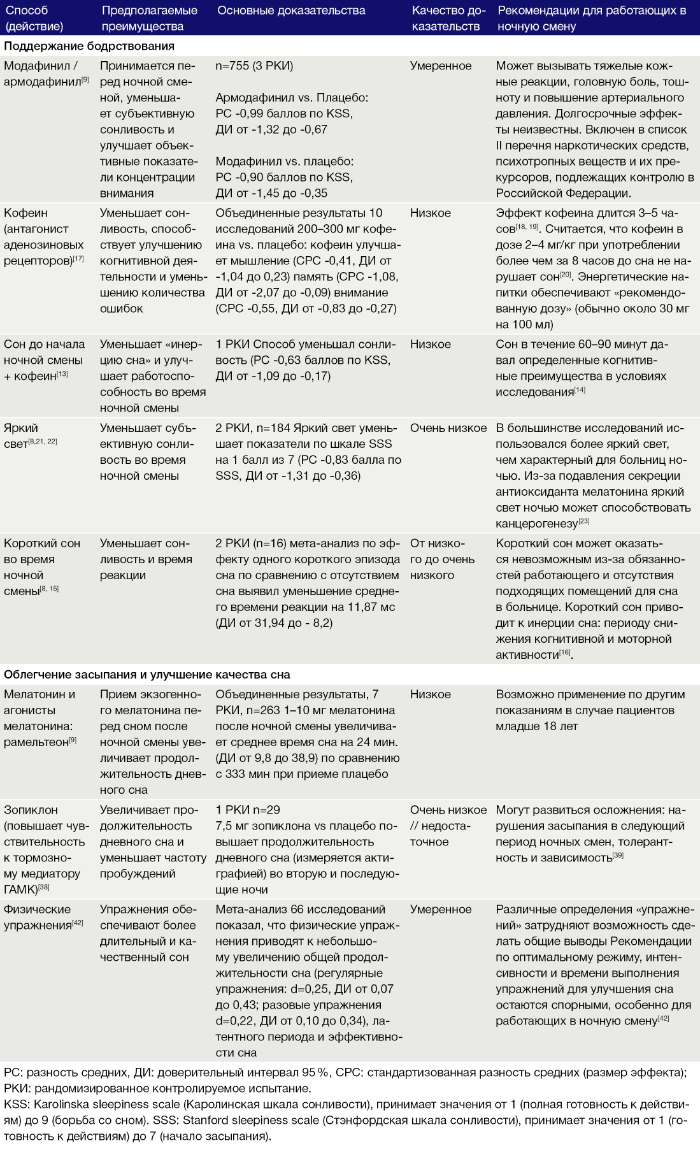
Повышение работоспособности в ночную смену (таблица 1)
Систематический обзор 13 небольших исследований с различным дизайном показал, что кратковременный сон во время ночной смены повышает концентрацию внимания и работоспособность [15]. Однако мета-анализ рандомизированных контролируемых испытаний показал низкое качество имеющейся доказательной базы [8]. Авторы советуют во время ночной смены спать не дольше 30 минут, чтобы избежать фазы медленного сна, пробуждение в которой сопровождается спутанностью сознания («инерцией сна») [16]. Систематический обзор 12 рандомизированных контролируемых исследований выявил, что при употреблении кофеина (по сравнению с плацебо) во время ночной смены или при смене часовых поясов наблюдается улучшение некоторых показателей когнитивной деятельности, таких как ориентированность, внимательность и мышление [17]. Учитывая фармакокинетику кофеина (пиковая концентрация достигается через 20–45 минут после употребления и сохраняется 3–5 часов) [18, 19], желательно избегать его употребления в течение минимум трех часов до предполагаемого отхода ко сну. Доза в 4 мг/кг, принятая за 8 часов до предполагаемого сна, по-видимому, не нарушает последующий сон [20]. Имеются данные среднего качества, указывающие на эффективность других стимулирующих препаратов, таких как армодафинил и модафинил: три рандомизированных контролируемых исследования с 755 участниками (в общей сложности) показали, что во время ночной смены эти препараты уменьшают сонливость по сравнению с плацебо [9]. Однако оба препарата могут давать серьезные побочные реакции со стороны кожи, а долгосрочные последствия применения этих препаратов не установлены. Теоретически воздействие яркого света во время ночной смены может уменьшать сонливость благодаря подавлению секреции стимулирующего сон гормона мелатонина, однако соответствующие исследования из-за проблем с дизайном не дали убедительных результатов [8, 21, 22]. Кроме того, считается, что уменьшение уровня мелатонина, также выполняющего функции антиоксиданта, может приводить к повышению заболеваемости раком среди работающих в ночную смену [23]. Поскольку доказательства того, что подобные вмешательства могут скорректировать ослабление психомоторной активности в ночное время, ограничены, авторы предлагают смягчить риск для работающих в ночную смену и [вместо подобных вмешательств — прим. перев.] ввести контроль основных этапов выполнения работы, особенно в ранние часы утра, когда физиологические функции достигают своего минимума [24, 25].
Когда есть
Пищеварение следует собственным циркадным ритмам: опорожнение желудка, перистальтика, функционирование печени, активность поджелудочной железы и толерантность к глюкозе в течение ночи снижаются [26]. Это затрудняет определение времени, подходящего для питания работающих в ночную смену: в двух небольших исследованиях, включавших примерно по 10 человек, у участников, не принимавших пищу во время имитированной ночной смены, работоспособность снижалась в меньшей степени, чем у принимавших пищу [27, 28]. Однако отсутствие приема пищи приводило к голоду и повышенной частоте желудочно-кишечных расстройств. Учитывая вышеописанные данные, авторы предлагают осуществлять основной прием пищи непосредственно перед ночной сменой, а затем принимать пищу в количестве, не превышающем необходимое для поддержания комфортного самочувствия во время смены.
Между сменами
После ночной смены гомеостатические стимулы, побуждающие ко сну, будут противодействовать циркадным стимулам к бодрствованию днем. Показано, что сдвиги фаз более чем на пять часов вызывают рассинхронизацию циркадных ритмов различных систем организма, поскольку эти системы адаптируются к сдвигу с разной скоростью [29]. При путешествии со сменой часовых поясов истинная циркадная адаптация занимает, по-видимому, один день на каждый часовой пояс [30], однако тот, кто работает в ночную смену, в дни отдыха сталкивается с конфликтующими сигналами из внешней среды (в т. ч. световыми) и социального окружения. В случае постоянного сдвига времени смен адаптация циркадных ритмов невозможна. Поэтому, чтобы компенсировать неизбежное нарастание недосыпания, на первое место должна выйти оптимизация сна в дни между ночными сменами. Эксперты в области гигиены сна поддерживают некоторые подходы для максимального улучшения качества и продолжительности сна. Однако из-за различий между людьми [31] и недостаточной доказательности рандомизированных контролируемых испытаний нельзя предложить какие-либо рекомендации, подходящие всем работающим в ночную смену. Большинство стратегий основаны на устранении факторов, способных нарушить сон. Они включают избегание яркого дневного света на пути домой (ношение солнцезащитных очков) и синего света на экранах компьютеров и телефонов [32]; сон в темноте и в спокойной обстановке, которую обеспечивают темные шторы, маски для сна, беруши или генераторы белого шума [33]. Погрузиться в сон помогает прохлада (относительно низкая температура) [34] или же привычная процедура перед сном, например, прием ванны, чтение или мягкая растяжка мышц [35, 36]. Избегайте стимуляторов, таких как кофеин или никотин, в течение по меньшей мере шести часов перед сном (из-за их фармакокинетических свойств) [37]. Эффективность зопиклона или бензодиазепинов короткого действия практически не доказана [38], и кроме того, прием этих препаратов может приводить к зависимости [39]. Эндогенный мелатонин координирует циркадные ритмы в различных тканях организма [40]. Показано, что прием мелатонина на следующее утро после ночной смены может увеличить продолжительность сна примерно на 24 минуты, однако эти данные получены в семи рандомизированных контролируемых испытаниях с относительно низким качеством доказательной базы [9].
Восстановление после ночных смен
После нескольких ночных смен необходимо сбалансировать устранение недосыпания и возвращение к нормальному ритму сна. Один из подходов к устранению недосыпания — позволить себе поспать в течение 1,5 или 3 часов (один или два полных цикла сна), а затем перестроиться на дневной режим: выйти на улицу на яркий дневной свет, пообщаться с людьми и постараться лечь в постель как можно ближе к обычному времени. Однако для определения эффективности такого подхода требуются дальнейшие исследования [29, 33, 41]. Мета-анализ 66 исследований позволяет предположить, что регулярные упражнения приводят к улучшению продолжительности и качества сна [42], но оптимальное время, длительность и тип упражнений для улучшения сна еще не определены.
К данной статье прилагается инфографика, на которой показана предлагаемая стратегия сна, основанная на имеющихся данных и экспертном мнении авторов. Просмотреть ее можно по ссылке — http://medach.pro/media-post/1680
Таблица 1 | Способы регуляции сна и бодрствования у работающих в ночную смену
Подробнее: https://vademec.ru/news/2018/10/23/tsifrovaya-sistema-pomozhet-poborot-moshennichestvo-s-retseptami/