Новости
Американский колледж акушеров и гинекологов (ACOG) обновил рекомендации по контролю послеродового кровотечения (ПРК). Представляя собой расширенную версию предыдущего руководства, проект включает в себя стандартные протоколы профилактики и лечения ПРК и потенциальные методы терапии, сообщает Medscape.
В соответствии с обновленным руководством ACOG, опубликованным в журнале Obstetrics & Gynecology, три составляющие активного управления третьим периодом родов могут способствовать снижению частоты послеродового кровотечения: введение окситоцина, массаж матки и контролируемые тракции за пуповину. В случае если послеродовое кровотечение вызвано атонией матки, в качестве первой линии терапии должны рассматриваться утеротонические средства, вызывающие сокращение матки. При неэффективности утеротонических препаратов рекомендуется баллонная тампонада матки и применение транексамовой кислоты.
ACOG определяет ПРК как кумулятивную кровопотерю, равную 1000 мл и более, наряду с признаками или симптомами гиповолемии в течение 24 часов после родов (включая интранатальную потерю), независимо от вида родоразрешения. Однако «потерю крови более 500 мл при вагинальном родоразрешении следует считать аномальной и рассматривать как показатель для исследования повышенного дефицита крови», пишут авторы работы.
При кровотечении, превышающем 500 мл при вагинальных родах и 1000 мл при кесаревом сечении в ближайшем послеродовом периоде, врачам рекомендуется провести тщательное обследование: быстрое физикальное обследование матки, шейки матки, влагалища, вульвы и промежности часто может помочь идентифицировать этиологию послеродового кровоизлияния.
При продолжающемся кровотечении с потерей крови более 1500 мл или при нарушениях жизненно важных функций (тахикардии и гипотонии) следует начинать немедленную подготовку к переливанию крови.
«Акушеры-гинекологи и медицинский персонал, оказывающий акушерскую помощь, должны быть знакомы с алгоритмами диагностики и контроля послеродового кровотечения», – заключили авторы работы.
Цель - проанализировать изменения артериального давления (АД) до и после тренировки во взаимосвязи с показателями ультразвукового исследования сердца и сосудов шеи у спортсменов-ветеранов.
Материал и методы. Проводилось анкетирование 200 конкурентоспособных спортсменов в возрасте от 40 до 72 лет для выявления основных факторов сердечно-сосудистого риска, измерялось АД в положении стоя в покое (до начала разминки) и непосредственно после спортивной нагрузки, выполнялось ультразвуковое исследование сердца и сосудов шеи. Учитывался установленный ранее врачом диагноз "артериальная гипертензия" (АГ).
Результаты. У 48% из всех обследованных регистрировалось систолическое артериальное давление (САД) выше 139 мм рт.ст. и у 42% - диастолическое (ДАД) выше 89 мм рт.ст. до начала разминки. После тренировочной нагрузки повышенное САД отмечалось у 39%, а повышенное ДАД - у 36% спортсменов-ветеранов.
По данным ультразвукового исследования, в среднем размеры камер сердца и диаметр сосудов шеи находились в пределах нормы. Гипертрофия миокарда левого желудочка (ЛЖ) встречалась у 48%, а диастолическая дисфункция - у 61%. Эти отклонения были в начальных стадиях практически у всех обследуемых. Большинство пациентов с гипертрофией ЛЖ и диастолической дисфункцией имели диагноз АГ (81 и 92%). У 80% комплекс интима-медиа (КИМ) был в пределах нормы.
Повышенные значения ДАД после тренировки ассоциировались с большей встречаемостью диастолической дисфункции, гипертрофии миокарда ЛЖ, относительно повышенными индексом массы миокарда ЛЖ, размерами предсердий и КИМ слева.
Заключение. Практически половина спортсменов среднего и пожилого возраста имеют диагноз "артериальная гипертензия", у трети обследованных без зарегистрированной АГ отмечается повышение АД >139/89 мм рт.ст. как до, так и после физической нагрузки. Повышение именно ДАД в ранний восстановительный период в большей мере, чем САД, ассоциируется с маркерами кардиоваскулярного риска: наличием гипертрофии левого желудочка, диастолической дисфункции и увеличением КИМ.
Ключевые слова:артериальная гипертензия, спортсмены-ветераны, кардиоваскулярный риск, физическая нагрузка
Для цитирования: Царева М.О., Шмойлова А.С., Шварц Ю.Г. Артериальная гипертензия и показатели ультразвукового исследования сердечно-сосудистой системы у спортсменов-ветеранов // Кардиология: новости мнения, обучение. 2019. Т. 7, № 1. С. 24-30. doi: 10.24411/2309-1908-2019-11003.
Одним из эффективных средств снижения кардиоваскулярного риска, в соответствии с современными руководствами, является регулярная физическая активность [1-3]. Дозированные физические упражнения ассоциируются со снижением вероятности фатальных и нефатальных коронарных событий, инсультов, а также общей смертности у лиц среднего и пожилого возраста.
Зависимость между пользой от физических нагрузок и их объемом в настоящее время активно исследуется, по некоторым данным, оно имеет нелинейный характер [4-7]. Продемонстрировано, что тренировка высокой интенсивности может быть связана с повышенным риском развития сердечной аритмии и даже первичной остановки сердца, особенно у предрасположенных лиц, уже имеющих заболевания сердечно-сосудистой системы. В отдельных работах установлено, что занятия спортом для достижения результатов являются фактором высокого кардиоваскулярного риска [8]. У ветеранов спорта, связанного с весьма высокими соревновательными нагрузками, велика вероятность развития миокардиального фиброза и ремоделирования сердца, причем предикторами последнего является высокое артериальное давление (АД) в момент нагрузки [9]. Особого внимания в этом плане заслуживают спортсмены-ветераны старше 40 лет, участвующие в командных или в индивидуальных видах спорта, требующих систематической подготовки и регулярного участия в крупных соревнованиях. Если ориентироваться на сведения с многочисленных сайтов ветеранского спорта и данные литературы, число таких спортсменов быстро растет [10]. Очевидно, в России счет идет на десятки, если не сотни тысяч. Как показали наши предыдущие исследования, практически половина спортсменов среднего и пожилого возраста имеют диагноз "артериальная гипертензия", из них менее половины получают регулярную антигипертензивную терапию.
У значительной части спортсменов-ветеранов отмечается повышение АД как до, так и после физической нагрузки, при этом треть спортсменов, не регистрирующих в повседневной жизни повышенные значения АД, имеют во время тренировки и соревнований систолическое АД (САД) выше 139 мм рт.ст., а около половины - повышение диастолического АД (ДАД) более 89 мм рт.ст. [11].
В крупных проспективных исследованиях лица, участвующие в соревнованиях и занимающиеся для достижения высокого результата, специально не выделялись. В этой связи заключения о том, что высокая физическая активность полезнее, чем умеренная, могут не касаться этих спортсменов.
Интенсивные физические нагрузки и эмоциональный стресс, которые неизбежны в спорте для достижения результатов, могут сопровождаться резким повышением артериального давления, увеличивать риск разрывов атеросклеротических бляшек и приводить к транзитор-ной активации системы свертывания крови и тромбообразованию [12], при этом длительно существующая неконтролируемая артериальная гипертензия под влиянием экстремальных физических нагрузок может усиливать уже существующую у спортсменов желудочковую дисфункцию [12].
Следует отметить, что четких границ для АД, измеряемого в таких условиях, не установлено. Именно поэтому трактовка такого рода стрессорного повышения АД пока затруднительна. Очевидно, частичное разрешение этой проблемы возможно при сопоставлении изменений АД во время спортивных занятий и морфофункционального состояния сердечно-сосудистой системы с использованием ультразвуковых методов. В этой связи следует отметить, что исследований с применением допплеровской эхокардиографии (ЭхоКГ) у немолодых соревнующихся спортсменов крайне мало, а работ, касающихся в этом плане артериальной гипертензии, практически нет.
Цель исследования - проанализировать изменения артериального давления до и после тренировки во взаимосвязи с показателями ультразвукового исследования сердца и сосудов шеи у спортсменов-ветеранов.
Материал и методы
В исследовании принимали участие 200 конкурентоспособных спортсменов в возрасте от 40 до 72 лет. Выбраны мало исследованные виды ветеранского спорта, в отличие от бега, относящиеся к группе весьма популярных и массовых в России: волейбол, хоккей и фехтование. Среди участников исследования насчитывались 151 мужчина и 49 женщин, средний возраст составил 52,9 лет. Общий спортивный стаж исследуемых - не менее 15 лет, в том числе не менее 3 лет занятий в последние годы. Все обследованные начинали спортивную карьеру в детстве, после чего следовал длительный перерыв с нерегулярными занятиями физической культурой. К критериям включения относилось и регулярное участие в соревнованиях областного, всероссийского или международного уровня.
Проводилось анкетирование для выявления основных факторов сердечно-сосудистого риска при помощи модифицированного нами опросника Говарда [13]. В данной работе учитывался установленный врачом диагноз "артериальная гипертензия" на основании зафиксированного ранее офисного АД ≥140 и 90 мм рт.ст. Лица, у которых такого диагноза не было, неоднократно измеряли в повседневной жизни свое домашнее АД и, в соответствии с общепринятыми критериями, не отмечали повышения домашнего АД ≥135 и 85 мм рт.ст. [14].
Проводилось измерение АД в положении стоя в покое (до начала разминки). Также стоя однократно измерялось АД после спортивной нагрузки: в течение 3-5 мин после 5-6 боев для фехтовальщиков, 2-3 игр для волейболистов и после одной игры у хоккеистов. По сути, измерение проводилось в период раннего восстановления.
Измерение АД проводилось в соответствии с рекомендациями [15] в положении стоя с использованием автоматического тонометра "Nissei WS-1011" осциллометрическим методом с местом наложения манжеты на запястье. Выбор данного тонометра обусловлен невозможностью использования классической манжеты в связи с наличием спортивной экипировки. Пределы допускаемой абсолютной погрешности для данного прибора при измерении давления воздуха в компрессионной манжете составили ±3 мм рт.ст.
Границами нормы считались значения АД 139 и 89 мм рт. ст., так как четких границ для АД, измеряемого в таких условиях, не установлено. Фиксировались случаи превышения нормы до и после нагрузки как для САД, так и для ДАД.
Ультразвуковое исследование выполнено у 46 случайно отобранных из общего числа спортсменов-ветеранов, сопоставимых по всем основным параметрам с общей группой.
Трансторокальная эхокардиография выполнялась на аппарате "Vivid 3 Pro vingmed technology" (General electric, США) в 1- и 2-мерном режимах с применением непрерывно- и импульсно-волнового допплера, цветного допплеровского картирования. Оценивали параметры полостей сердца. Учитывалось наличие гипертрофии миокарда и диастолической дисфункции как признаков поражения органов-мишеней, с применением общепринятых критериев [толщина миокарда левого желудочка ≥12 мм, величина конечно-диастолического размера (КДР) ≥64 мм] [16]. При проведении дуплексного сканирования сосудов брахиоцефального ствола оценивались диаметр артерий, скорость линейного кровотока (ЛСК), толщину комплекса интима-медиа (КИМ) общей сонной артерии (ОСА) и области бифуркации ОСА. Измерения осуществляли по стандартному протоколу на 3 уровнях сосудистого русла и билатерально в дистальной, медиальной и проксимальной точках задней стенки дистального сантиметра ОСА в конце диастолы [17, 18]. Границу величины КИМ оценивали между линиями, соответствующими внутреннему краю tunica adventicia и краю tunica intima, граничащему с просветом сосуда, по методике P. Pignoli и соавт. [19]. Использовали звуковую систему "Vivid 3 Pro", высокочастотный датчик 10 МГц.
Статистическую обработку полученных данных проводили с помощью программы Statistica 8.0 с использованием параметрических и непараметрических методов. В качестве характеристик групп использовались средние величины, стандартные отклонения. Динамику показателей оценивали с помощью критерия Краскела-Уоллиса, сравнения встречаемости признаков - %2, Йетса и Фишера.
Предполагалось, что превышение границ используемой в исследовании нормы АД при занятиях спортом можно оценить как негативный признак, а АД ≥140/90 мм рт.ст. как повышенное, в случае если это явление ассоциируется с неблагоприятными клиническими и инструментальными показателями, т.е. с признаками поражения органов-мишеней.
Результаты
По результатам проведенного анкетирования 54% опрошенных был выставлен диагноз "артериальная гипертензия". 20% курили ранее и 20% курят на данный момент. Индекс массы тела (ИМТ) колебался от 20,03 до 39,45 кг/м2 и в среднем составил 26,3±3,4 кг/м2. Отягощенная по инфаркту миокарда наследственность отмечалась у 19% лиц, по инсульту - 17%.
По данным УЗИ в среднем размеры камер сердца и диаметр сосудов шеи были в пределах нормы. Гипертрофия миокарда левого желудочка встречалась у 48%, а диастолическая дисфункция - у 61%. Эти отклонения в начальных стадиях были практически у всех обследуемых. Большинство пациентов с гипертрофией ЛЖ и диастолической дисфункцией имели диагноз АГ (81 и 92%). У 80% КИМ был в пределах нормы.
Исследование в условиях спортивной тренировки показало, что 48% из всех обследованных имели повышенное САД (выше 139 мм рт.ст.) и 42% - повышенное ДАД (выше 89 мм рт.ст.) еще до начала разминки. После тренировочной нагрузки повышенное САД регистрировалось почти с той же частотой (у 39%), а повышенное ДАД - у 36% спортсменов-ветеранов. Отмечались достоверная, но не абсолютная связь между АД до и после тренировки. Так, среди спортсменов с исходно нормальным ДАД у 17% после тренировки оно повысилось. У лиц с повышенным ДАД в 39% случаев после физической нагрузки наступила нормализация этого параметра. При исходно нормальном САД повышение произошло у 20% лиц, при этом физическая нагрузка "нормализовала" значения САД у 41% ветеранов спорта с исходно повышенным давлением.
Как видно из табл. 1, САД и особенно ДАД как до, так и после нагрузки были повышены почти у половины обследованных, причем чаще у спортсменов, страдающих АГ. Следует отметить, что немало - почти У3 лиц - без установленной АГ также имели повышенное АД до и после тренировки.
Что касается других изучаемых факторов кардиоваскулярного риска, зависимость от повышенного АД отмечалась только у ИМТ. Повышение АД до и особенно после тренировки ассоциировалось с относительно большим ИМТ. Повышенное после нагрузки САД было характерно для более возрастных лиц. В отношении пола, курения, отягощенного семейного анамнеза такой взаимосвязи не отмечалось.
При анализе данных ультразвукового исследования оказалось, что превышение нормы АД перед тренировкой с этими показателями практически не взаимосвязано. Отмечено лишь, что фракция выброса в среднем у лиц с повышением САД была статистически значимо (р<0,05) выше (71,4±3,9%), чем у лиц с нормотонией (68,4±3,5%), перед тренировкой.
У результатов измерения АД после нагрузки установлены значимые взаимосвязи с показателями УЗИ (табл. 2).
Повышенные значения САД ассоциировались с большей встречаемостью диастолической дисфункции, гипертрофии миокарда левого желудочка и, соответственно, относительно повышенным ИММЛЖ.
Повышение ДАД после нагрузки имело значительно больше ассоциаций с показателями УЗИ (табл. 3). Так, кроме значимой тенденции к диастолической дисфункции и гипертрофии левого желудочка, у лиц с повышением ДАД отмечались относительно большие размеры предсердий, а при исследовании сонных артерий - больший КИМ слева и тенденция к большим значениям КИМ справа.
Обсуждение
Увеличение количества обследованных в 2 раза по отношению к нашей предыдущей работе [11] не привело к существенному изменению результатов в отношении показателей АД. Среди исследуемых нами спортсменов наблюдается такая же распространенность АГ, как и среди населения РФ среднего и пожилого возраста, не имеющего отношения к спорту [20, 21]. Однако в данном исследовании выявляется повышение АД до и после тренировки среди спортсменов, успешно лечащихся от АГ. Также отмечалось повышение АД более 139 и 89 мм рт.ст. у части лиц, не имеющих диагноза АГ и не фиксирующих повышения АД в повседневной жизни. Частота этого явления практически совпадает с распространенностью маскированной АГ, выявленной при обследовании немолодых спортсменов [9] при суточном мониторировании АД. Возможно, именно с этим феноменом мы имели дело.
Следует отметить, что повышение АД до тренировки не обязательно обозначало, что оно будет повышенным и после. И, наоборот, у лиц с исходно нормальным АД после физической нагрузки фиксировалось повышенное АД.
Значительная частота и выраженность повышения уровня АД среди спортсменов с диагнозом АГ может свидетельствовать об относительно повышенном риске сердечно-сосудистых событий у данных спортсменов, возникающих на фоне стрессовой ситуации в условиях соревнований. Очевидно, повышенное давление у наших обследуемых до и после спортивных нагрузок можно считать повышенным лишь условно, поскольку нормы разработаны для состояния покоя и не существует четких рекомендаций по интерпретации значений АД в изучаемых нами условиях. В этой связи важно подтвердить допустимый уровень повышения АД перед тренировкой и в период раннего восстановления, т.е. ответить на вопрос о благоприятной и неблагоприятной реакции на спорт. Норму для офисного АД мы условно и несколько произвольно перенесли в условия тренировочного процесса. Однако выявленные тенденции (нормальное АД у половины спортсменов, зависимость результатов измерений от наличия АГ) в определенной мере позволяют опираться на установленные границы. Очевидно, для более точного разграничения необходимы очень крупные проспективные исследования. В ближайшие годы подобных результатов вряд ли стоит ждать. Более того, даже норма для офисного АД регулярно пересматривается [14, 22].
Сопоставление АД у наших обследованных с результатами УЗИ в некоторой мере подтвердило правомерность выбранного нами подхода.
Оказалось, что частота встречаемости гипертрофии левого желудочка (ГЛЖ) и диастолической дисфункции у спортсменов-ветеранов значительно не отличалась от показателей, характерных для пациентов с АГ сходного возраста [7]. Поскольку эти явления в основном отмечались у лиц с АГ, вряд ли такую ГЛЖ можно назвать спортивной.
Взаимосвязь между показателями УЗИ и АД до и после тренировки принципиально отличалась. Вероятно, должна отличаться и интерпретация измерений.
До тренировки САД выше 139 мм рт.ст. ассоциировалось с относительно высокой фракцией выброса (ФВ), что может отражать склонность кровообращения к гипердинамии. Не установлено никаких других существенных ассоциаций. В этой связи можно считать, что предстартовая гипертензия в большей мере отражает эмоциональный и вегетативный компонент и может не относиться к патологическим явлениям.
Что касается повышенного АД в ранний восстановительный период, очевидно, что это это неблагоприятный маркер. Ассоциация АД >139/89 мм рт.ст. с признаками гипертрофии и диастолической дисфункции левого желудочка подтверждает это. Не исключено, что гипертензивная реакция на нагрузку, и не только спортивную, внесла свой вклад в формирование выявленных изменений левого желудочка.
Следует отметить, что ДАД больше 89 мм рт.ст. может претендовать на роль более явного негативного показателя, ибо связано с относительно большими размерами предсердий и величиной КИМ. Более того, превышение нормальных значений КИМ отмечено только у лиц с повышенным ДАД после тренировки. И, напротив, у лиц с нормальным ДАД КИМ не выходил за пределы нормы.
Следовательно, ДАД >89 мм рт.ст. после нагрузки может служить индикатором неблагоприятных изменений в сердечно-сосудистой системе, в частности повышенного кардиоваскулярного риска, так как и ГЛЖ, и диастолическая дисфункция (ДД), и повышенный КИМ являются недвусмысленными его показателями.
Данное исследование не позволяет судить о том, полезны или вредны для лиц с такой реакцией АД, в частности для больных АГ, интенсивные занятия спортом. Отдельные исследования [2, 3] позволяют надеяться, что риск неблагоприятных событий у таких спортсменов как минимум не выше, чем у аналогичных больных АГ, не занимающихся физическими упражнениями.
Необходимость коррекции антигипертензивной терапии в том случае, когда офисное и измеренное дома АД нормальное, но повышено после тренировок, пока должна обсуждаться с учетом мнения экспертов. Обсуждение это весьма актуально, поскольку результатов крупных рандомизированных клинических испытаний по данной проблеме в ближайшие годы не ожидается.
Представляется, что в этом случае в отношении спортсменов с АГ и повышением АД после спорта можно обсуждать как минимум 3 варианта вмешательства:
1) возможность дополнительного приема короткодействующих антигипертензивных препаратов (каптоприл) непосредственно перед тренировками и соревнованиями; 2) смещение времени приема назначенных препаратов; 3) при выборе целевого офисного давления акцент на более агрессивные рекомендации AHA [22]. Варианты нам кажутся вполне приемлемыми, хотя четких показаний и критериев эффективности в этом плане пока не разработано, и проблема нуждается в дальнейшем изучении. В любом случае измерение, в том числе и самоизмерение, АД до и, особенно, после занятий спортом весьма полезно.
Выводы
1. Практически половина спортсменов среднего и пожилого возраста имеют диагноз "артериальная гипертензия".
2. Около трети спортсменов-ветеранов без зарегистрированной АГ отмечают повышение АД >139/89 мм рт.ст. как до, так и после физической нагрузки.
3. У спортсменов-ветеранов, по данным УЗИ, в среднем значения размеров камер сердца и характеристики сосудов шеи находились в пределах нормы. Гипертрофия миокарда левого желудочка встречалась у 48%, а диастолическая дисфункция у 61%, в основном у больных АГ.
4. Обращает на себя внимание, что, в отличие от повышения АД до спортивной нагрузки у спортсменов-ветеранов, повышение именно ДАД в ранний восстановительный период в большей мере ассоциируется с маркерами кардиоваскулярного риска: наличием гипертрофии левого желудочка, диастолической дисфункции и увеличением КИМ.
Конфликт интересов. Авторы заявляют об отсутсвии конфликта интересов.
АУДИОЗАПИСЬ ПРИЛАГАЕТСЯ:
асстройства аутистического спектра (РАС) — это широкая группа нарушений развития, которую объединяет наличие качественных нарушений социального взаимодействия, коммуникации, а также повторяющийся стереотипный характер поведения и интересов. Симптомы должны быть заметны до достижения ребенком возраста трех лет. Аутизм — это клинический диагноз, то есть ставится только на основании наблюдения за поведением ребенка.
Спектр проявления аутизма очень широкий. Перед вами может быть ребенок с выраженной интеллектуальной недостаточностью или, напротив, с высокими когнитивными способностями, вплоть до одаренности. Может иметь место грубая задержка речевого развития, или, наоборот, речь будет не по возрасту развитой и богатой. Объединяют эти случаи нарушения сферы социального взаимодействия и коммуникации. А причины и патогенетические механизмы могут быть различны. Так, например, известно более 200 генов, изменения в работе которых ассоциированы с развитием аутистической симптоматики.
Социальное взаимодействие
Прогноз развития и успешности социальной адаптации неоднозначный. Вообще, если учесть ширину спектра аутистических расстройств, очень сложно представить какого-то медианного ребенка с этим заболеванием. Прогноз будет зависеть от того, с какой именно формой аутизма мы имеем дело.
Согласно исследованиям, прогноз для людей с аутизмом и интеллектуальной недостаточностью хуже, чем для людей просто с интеллектуальной недостаточностью, например с синдромом Дауна. Точно так же, если говорить о высокофункциональных аутистах — людях с нормальным интеллектом, — их возможности реализации (самостоятельное проживание, получение специальности, работа) гораздо хуже, чем у нейротипичных сверстников. Для того чтобы понять, почему так происходит, рассмотрим подробнее, что такое социальное взаимодействие и коммуникация и как они нарушаются при аутизме.
Социальное взаимодействие — это любое действие человека, в основе которого лежит социальный мотив. Например, улыбка, с помощью которой вы располагаете собеседника к себе. Зрительный контакт: во время разговора мы смотрим друг на друга и оцениваем, понимает ли нас собеседник, интересно ли ему то, что мы говорим. Стремление разделить какие-то свои хорошие и плохие переживания. Не будет преувеличением сказать, что любое наше поведение в какой-то степени имеет социальную направленность. Представим ситуацию: ребенок идет в школу, там он старается получить хорошую оценку, так как хочет, чтобы его похвалили родители. В основе его действий лежит социальный мотив: он это делает для признания его другим человеком, а вовсе не потому, что цифра 5 красивее цифры 2. Так происходит в норме. Так происходит и при других нарушениях развития, которые не сопровождаются симптомами аутизма. У детей с аутизмом эти формы поведения нарушены уже в раннем возрасте.

Нарушения приводят к тому, что ребенок с раннего возраста будет лишен форм обучения, которые заключаются в передаче опыта во время общения. Одним из ранних признаков аутизма является нарушение способности проследить взгляд другого человека. Ребенок не понимает, куда смотрит его собеседник, а значит, не понимает, что привлекло его внимание, что интересно, а что опасно, про что сейчас говорит мама. Представьте себе обычную ситуацию: мама комментирует ребенку то, что видит: «Вот собачка побежала, вот кошка, вот самолет полетел». Она это делает, понимая, что внимание ребенка направлено туда же, куда и ее внимание, что они смотрят на одно и то же. Теперь представьте, что ребенок не способен проследить ее взгляд, вообще не использует эту информацию. Прежде всего, никакой связи между тем, что ребенок видит, и тем, что ему говорят, не будет. Одно это уже является существенным фактором задержки речевого развития. Другой пример — указательный жест, когда ребенок показывает пальцем на то, что привлекло его внимание. Это способность направить внимание другого человека на то, что тебе нужно. Отсутствие этих навыков у ребенка в 1,5 года — очень серьезная причина для беспокойства.
В продолжение темы нарушения социального взаимодействия можно упомянуть концепцию «модели психического» (в оригинале — Theory of mind). Модель психического — это наши представления о том, что знает, любит, чем интересуется, о чем думает другой человек. Когда мы начинаем какой-то разговор, мы начинаем его не с произвольного места, а ориентируемся на то, что наш собеседник уже знает. Правильнее сказать — на то, что, по нашему мнению, он знает. Это и есть модель психического, наша модель его образа мыслей. Иногда мы ошибаемся, тогда возникает взаимонепонимание. Но модель психического — это не врожденная способность. Маленькие дети не слишком склонны вставать на позицию другого человека и считают, что все, что знают они, знает другой человек. С определенного возраста они начинают понимать, что это не так. Это может показаться грустным, но хорошим критерием зрелости модели психического является появляющаяся способность обманывать. Были исследования, которые показали, что по крайней мере у части детей с аутизмом модель психического развивается с существенной задержкой и искажением. Это означает, что у детей нет представлений о мыслях, знаниях и чувствах другого человека и что в своем поведении они не будут использовать эту информацию в качестве ориентира.
Следующая группа симптомов — нарушения коммуникации. Коммуникация — это обмен информацией. Она бывает вербальной, когда мы передаем информацию посредством речи, письменной или устной, и невербальной — это жесты, мимика, которые в норме тоже очень выразительны и могут до определенной степени заменить речевое общение.
У людей с аутизмом в большинстве случаев речь развивается с задержкой или выраженным своеобразием. Задержка чаще всего проявляется в более позднем появлении слов и фраз, специфических аграмматизмах. Речь часто стереотипная, зачастую ребенок говорит только цитатами или заученными фразами, а самостоятельно предложения не строит. Частый симптом — эхолалия — повторение только что услышанного высказывания. В любом случае, вне зависимости от уровня развития речи, главным признаком будет то, что речь не используется для общения. Невербальная коммуникация — жесты и мимика — также нарушена при аутизме. Ребенок с задержкой развития речи будет изъясняться жестами, мимикой и сможет донести до вас свою мысль. Ребенок с аутизмом этого делать не будет.
Третья группа симптомов — это стереотипный, ограниченный характер интересов. Существует много вариантов, как это может проявляться. Высокофункциональные люди с аутизмом могут углубленно изучать какую-то одну узкую тему, будут говорить только на эту тему и больше ни на что не обращать внимания. У детей с задержанным развитием это будет проявляться в более грубых формах. Это может иметь вид сенсомоторных стереотипий, когда дети фиксируются на каких-то конкретных ощущениях: смотрят на воду, или перебирают пальцами около глаз, или фиксируются на каких-то звуках. В основе этого поведения — стремление получать одинаковые ощущения. Поэтому эта группа симптомов очень трудна для коррекции. Ребенок хочет получать одинаковые ощущения, научается их получать, все время стремится вернуться к этой деятельности, для реализации которой ему никто не нужен. Это деятельность, которая сама себя подкрепляет и не содержит в себе никакого развития.
Процесс социализации
Понимая весь тот спектр нарушений, которые подразумевает слово «аутизм», действительно становится понятно, что преодоление этих дефицитов — это крайне сложная задача. Мы имеем дело с формой развития, при которой нарушены базовые механизмы, позволяющие ребенку взаимодействовать с окружающим миром, приобретать новый опыт, ориентируясь на опыт других людей. Причем выключенность из социума, из социальных ориентиров начинается очень рано. Сегодня не существует способов медикаментозного лечения аутизма, поскольку неизвестны механизмы возникновения заболевания. Есть лишь ряд препаратов, которые могут временно снизить выраженность некоторых симптомов, в первую очередь связанных с повышенным возбуждением.

Единственный выход, который существует, — это психологическая и педагогическая коррекция. На настоящий момент наиболее эффективной считается методика прикладного анализа поведения (Applied Behavior Analysis — ABA), основанная на принципах бихевиоризма. Идея в том, что любое поведение имеет причину, которая его вызывает, и последствия, которые могут его подкреплять или, наоборот, гасить. Коррекция поведения будет заключаться в успешном манипулировании стимулами внешней среды. Это позволит сформировать необходимые навыки и купировать нежелательное поведение. При этом подходе все сложные навыки разбиваются на мелкие блоки — действия. Каждое действие разучивается с ребенком отдельно, затем действия соединяются в цепь, образуя сложное действие.
Чаще всего, однако, преодолеть все трудности развития не удается, поэтому движение должно быть двусторонним. Социализация — это жизнь в обществе: обучение в школе, поход в музей, или театр, или магазин, получение профессии. Поэтому возможности социализации ребенка напрямую зависят от возможности общества принять этого ребенка. Сейчас у нас развивается инклюзивное образование, и дети с особенностями развития могут обучаться в массовых школах, а школа должна иметь возможность принять любого ребенка. Это очень сложный и тернистый путь, который плохо продуман, мало понятен его участникам и для каждого конкретного ребенка может оказаться неудачным. Но в итоге, я думаю, на поколенческом уровне эта практика даст результаты. Современные дети вырастут, зная, что среди нас есть люди с особенностями развития: с аутизмом, синдромом Дауна, с другими заболеваниями. И тогда люди с аутизмом будут меньше изолированы от общества. Чем больше общество осведомлено о том, насколько оно неоднородно, тем проще оно будет воспринимать непохожих людей и тем больше людей с особыми потребностями будут в него встроены.
Пока диабет не удаётся излечивать, но своевременная (то есть как можно более ранняя) и правильная интенсификация лечения может привести к устойчивому качественному гликемическому контролю и существенно задержать проявление осложнений.
В новом исследовании, результаты которого опубликованы в The Lancet, учёные сравнили раннюю терапию диабета 2 типа метформином и комбинированную терапию, сочетающую метформин (metformin) и вилдаглиптин (vildagliptin).
Участники исследования (2001 человек) были случайным образом разделены на группы для получения лечения метформином в дозировке до 1000 мг в сочетании с 50 мг вилдаглиптина дважды в день, только метформином или плацебо. Всем участникам диабет диагностировали в течение последних двух лет, и они все имели уровни гликогемоглобина 48—58 ммоль/моль (6,5—7,5 %). Такой показатель удостоверяет, что они находились на относительно ранних стадиях заболевания. Они ранее не получали лекарственной терапии или употребляли метформин менее месяца до начала исследования.
Терапевтическая неудача, то есть, достижение уровня гликогемоглобина 53 ммоль/моль или выше, при двух последовательных визитах исследователей (они проводились каждые 3 месяца), наблюдалась в 62,3 % случаев в группе, где пациенты принимали только метформин, по сравнению с 43,6 % в группе с комбинированным применением препаратов.
В монотерапевтической группе среднее время достижения терапевтической неудачи составило 36,1 месяцев, а в комбинированной — 61,9 месяца. Это можно приравнять к снижению риска при комбинированном лечении в сравнении с монотерапией на 49 %.
«Можно выиграть терапевтическое окно продолжительностью два года», — сказал журналистам Дэвид Маттьюз (David Matthews) из Оксфордского университета (University of Oxford).
Пациенты, потерпевшие терапевтическую неудачу, продолжали лечение без контроля плацебо метформином и вилдаглиптином до следующей точки терапевтической неудачи, заключающейся в необходимости начала приёма инсулина. Если требовалось другое лекарство, не инсулин, пациенты выбывали из исследования.
Важно отметить, что пациенты, проходившие комбинированную терапию на первом этапе исследования, также показали лучшие результаты на втором этапе. У тех, кто начал монотерапию метформином, наблюдался более быстрый переход к инсулиновой зависимости (вторичная терапевтическая неудача), несмотря на добавление вилдаглиптина после прохождения первого этапа терапевтической неудачи.
Выигрывают ли пациенты в долгосрочной перспективе от получения более интенсивной терапии с самого начала — это, по словам Маттьюза, «серьёзный вопрос для диабетиков».
У тех, кто принимал вилдаглиптин с самого начала, наблюдалось значительное замедление, на 26 %, наступления второго этапа терапевтической неудачи.
Предварительное лечение вилдаглиптином не привело к увеличению веса по сравнению с лечением исключительно метформином, и показатели гипогликемии в обеих группах были одинаковы.
Несмотря на то, что исследование не было направлено на оценку последствий для сердечно-сосудистой системы, исследователи обнаружили некоторые свидетельства задержки первого выявления макрососудистого события в группе с предварительной комбинированной терапией, из чего следует, что более интенсивный гликемический контроль привёл к снижению риска развития сердечно-сосудистых осложнений. Тем не менее, данный вывод был основан на очень небольшом количестве случаев — 2,4 % в группе с комбинированной терапией и 3,3 % в группе, принимавшей только метформин.
Соавтор исследования, Стефано Дель Прато (Stefano Del Prato) из Пизанского университета (итал. Università di Pisa), подчеркнул, что анализ результатов макрососудистых результатов носит чисто зондирующий характер и требует специального исследования для воспроизведения полученных данных. Однако он назвал отмеченные результаты интригующими, учитывая, что участники исследования с ранней стадией диабета сильно отличаются от групп населения повышенного риска, представители которых продемонстрировали кардиозащитную пользу препаратов от диабета.
Дель Прато отметил также, что помимо вилдаглиптина и метформина существует множество других комбинаций препаратов первой линии. «Мы считаем, — сказал он, — Что данное исследование открывает новую эру изучения потенциальной выгоды комбинирования различных препаратов для людей с диабетом 2 типа».
Хроническое употребление алкоголя поражает все органы и системы. Но особое внимание стоит уделить алкогольным заболеваниям печени, которые включают в себя различные патологические состояния: от простого стеатоза до воспаления, цирроза и алкогольного гепатита [1].
Алкогольная болезнь печени является одним из наиболее распространенных заболеваний печени в Европе и США [3]. Заболевание может быть вызвано хроническим употреблением алкоголя, превышающим определенное суточное количество. Хроническое употребление > 40 г этилового спирта в день (что составляет 375 мл 13 % вина или > 1 литра 5 % пива) в течение длительного периода времени (годы) ассоциировано с высоким риском развития алкогольной болезни печени [4].
По результатам метаанализа, даже хроническое потребление 12–24 г алкоголя в день ассоциировано с повышенным риском развития цирроза печени (поздняя стадия алкогольной болезни печени), по сравнению с риском для людей, не употребляющих алкоголь [4]. Несомненно, вероятность развития цирроза печени зависит от продолжительности употребления алкоголя [1].
Алкогольная болезнь печени начинается с алкогольной жировой дистрофии, для которой характерен стеатоз печени — накопление триглицеридов в гепатоцитах. У некоторых людей прогрессирует воспаление печени, повреждение гепатоцитов и их увеличение, которое гистологически определяется как алкогольный стеатогепатит (АСГ) [2].
АСГ может развиваться медленно, с постоянным хроническим повреждением печени и воспалением, в конечном итоге приводящим к прогрессирующему фиброзу и циррозу. Впоследствии это может привести к развитию гепатоцеллюлярной карциномы (ГЦК). В дополнение к этому, у людей с АБП (с циррозом или без него) с быстро прогрессирующим АСГ может наблюдаться алкогольный гепатит, который ассоциирован с плохим прогнозом для пациента [2].
.
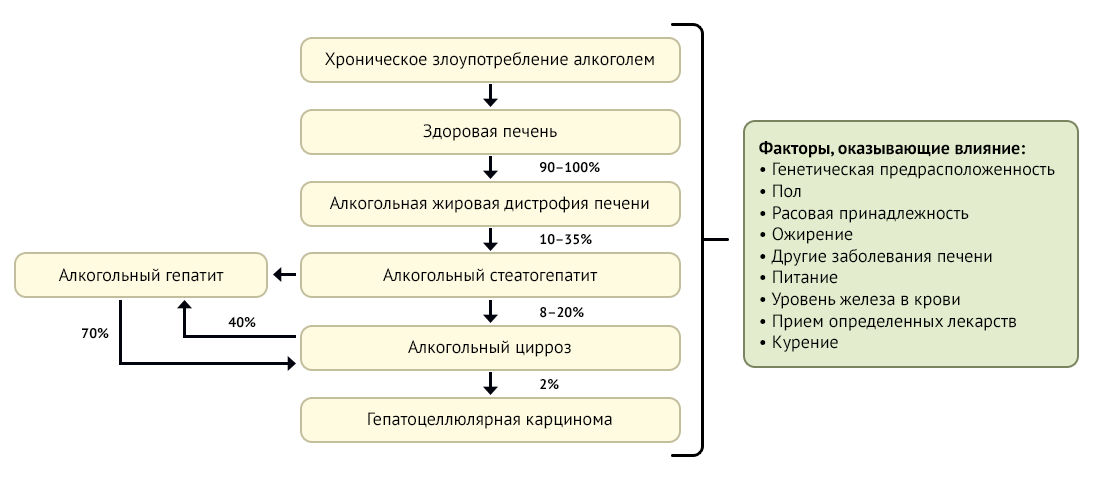
Факторы риска
Существует взаимосвязь между количеством потребляемого алкоголя и риском развития АБП [5]. У большинства (90–100 %) хронических алкоголиков развивается алкогольная жировая дистрофия печени. У 10–20 % хронических алкоголиков развивается прогрессирующая АБП [2].
Среди факторов риска генетическая предрасположенность имеет наибольшее значение [6]. Женщины подвержены большему риску, чем мужчины. АБП у женщин развивается быстрее и при употреблении более низких доз алкоголя [7]. Наличие таких заболеваний печени, как вирусный гепатит B [9] или C [10], наследственный гемохроматоз [11], дефицит α1-антитрипсина [8] и неалкогольный стеатогепатит [12], ассоциировано с повышенным риском развития АБП. Люди с избыточным весом более склонны к токсическому воздействию алкоголя на печень [13]. Прием определенных лекарств или витаминов (парацетамола, изониазида, метотрексата, β-каротина) в сочетании с алкоголем способствует повреждению печени [14]. Курение увеличивает риск развития АБП в три раза [15].
Патофизиологические механизмы
В развитие алкогольной жировой дистрофии печени вносят вклад метаболические изменения, эпигенетические изменения, окислительный стресс и воспаление. Перечисленные факторы воздействуют в первую очередь на гепатоциты и звездчатые клетки печени [2].
Генетика
Среди генов, влияющих на чувствительность организма к хроническому употреблению алкоголя, гены модификаторов нейротрансмиссии (ГАМК) и модификаторов метаболизма алкоголя [17].
Отмечена роль полиморфизмов генов, которые [18]:
• кодируют медиаторы воспаления — фактор некроза опухоли (TNF) и антагонист рецептора IL-1;
• участвуют в ответе на действие эндотоксина — рецептор CD14 и CTLA4;
• участвуют в окислительном стрессе — глутатион-S-трансфераза и марганцевая супероксиддисмутаза.
Ацетальдегид и окислительный стресс
Алкоголь в гепатоцитах окисляется алкогольдегидрогеназой до ацетальдегида, который затем метаболизируется до ацетата. Цитохром P450 2E1 (CYP2E1) — фермент, присутствующий в эндоплазматической сети и митохондриях гепатоцитов, метаболизирует алкоголь до ацетальдегида в присутствии кислорода и НАДФ. Такой метаболизм алкоголя является альтернативным, и этот путь запускается при хроническом злоупотреблении алкоголем (рис. 3) [2].
.
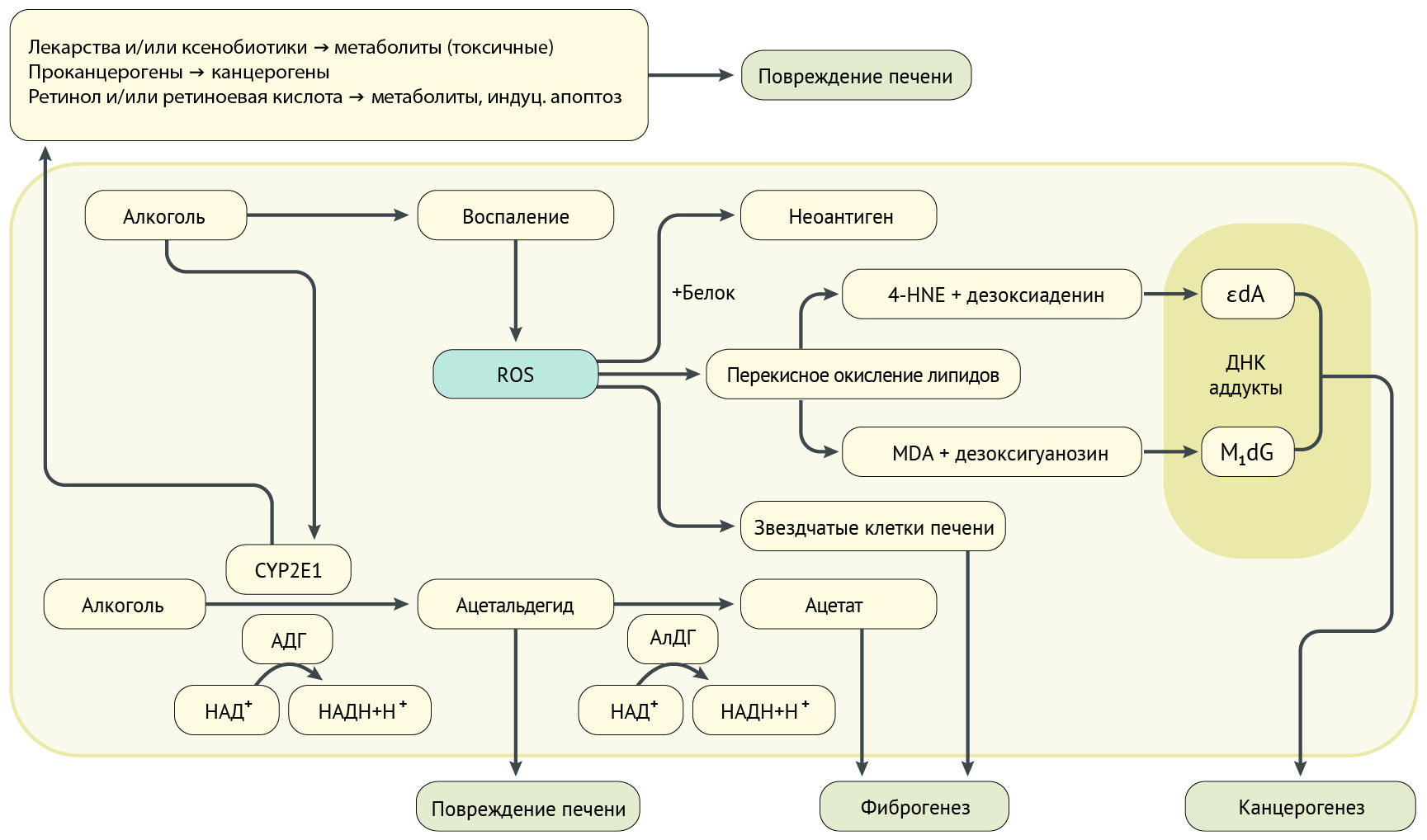
Ацетальдегид является токсичным и канцерогенным, связывается с белками, что приводит к структурным и функциональным изменениям митохондрий и микротрубочек и индуцирует образование неоантигенов [19]. Структурные изменения митохондрий приводят к снижению образования АТФ в дыхательной цепи, выработке активных форм кислорода (АФК) и окислительному стрессу, а также снижению активности ацетальдегиддегидрогеназы [16].
Эпигенетика
Эпигенетические изменения включают ацетилирование и фосфорилирование, а также гипометилирование ДНК и изменения микроРНК [2].
Алкоголь модулирует ацетилирование гистона H3 посредством индукции активности гистонацетилтрансферазы и ингибирования гистондеацетилазы [20]. Происходит снижение экспрессии Sirtuin 1 в гепатоцитах, что приводит к усиленной регуляции стерол-регуляторного элемента, связывающего фактор транскрипции 1 (SREBP1), и последующему снижению метаболизма липидов в печени, что ведет к ожирению печени [21]. Связанная с алкоголем эпигенетическая регуляция также изменяет функции иммунных клеток. У макрофагов повышается активность гистондеацетилазы 11, регулятора IL-10, и это способствует снижению продукции противовоспалительного цитокина IL-10 [22].
Стеатоз печени
Первым патофизиологическим ответом на хроническое употребление алкоголя является накопление жира (в основном триглицеридов, фосфолипидов и сложных эфиров холестерина) в гепатоцитах (стеатоз печени), что может привести к алкогольной жировой дистрофии печени. Потребление алкоголя может вызывать накопление жира в печени при помощи нескольких механизмов [2]:
1. Потребление алкоголя повышает отношение восстановленного НАД к окисленному НАД (НАДН/НАД+) в гепатоцитах, что препятствует β-окислению жирных кислот в митохондриях и приводит к стеатозу.
2. Потребление алкоголя может усиливать экспрессию в клетках печени SREBP-1c — транскрипционного фактора, который стимулирует экспрессию липогенных генов, что приводит к увеличению синтеза жирных кислот.
3. Алкоголь инактивирует рецептор-α, активируемый пролифератором пероксисом (PPARα). Это ядерный гормональный рецептор, который усиливает экспрессию многих генов, участвующих в транспорте и окислении свободных жирных кислот.
4. Употребление алкоголя вызывает липолиз и гибель адипоцитов, что приводит к повышению концентрации циркулирующих жирных кислот и их последующему накоплению в печени.
Ингибирование убиквитин-протеасомного пути
Убиквитин-протеасомный путь регулирует переваривание белка в клетке. С помощью данного механизма регулируются многие функции клеток печени, включая контрольные точки клеточного цикла и активацию факторов транскрипции (например, NF-κB и индуцируемый гипоксией фактор 1α — HIF1α). Потеря протеасом или ингибирование этого пути может привести к повреждению клеток, апоптозу и накоплению агрегированных цитокератинов в печени. Экспрессия генов в клетках печени зависит от активации транскрипционного фактора протеасомами. Активация определенных генов может ингибировать воспалительную реакцию печени и реакцию на гипоксическое повреждение [2].
Фиброз и цирроз
Фиброгенез является предпосылкой развития цирроза печени. На более поздних стадиях АБП характеризуется развитием запущенного фиброза, что ассоциировано с ранней смертностью пациентов. Фиброз при AБП отличается накоплением перицеллюлярного и перисинусоидального матрикса. Постоянное употребление алкоголя усугубляет процесс [2].
Алкоголь, ацетальдегид и АФК (рис. 2) могут способствовать фиброгенезу печени, стимулируя иммунные клетки к образованию профиброгенных медиаторов. Алкоголь-опосредованное ингибирование нескольких антифиброзных путей также способствует фиброзу печени. Когда фиброз прогрессирует, печень становится цирротической и состоит преимущественно из соединительной ткани, что приводит к серьезному нарушению печеночного кровотока из-за сужения сосудов в печеночной дольке. В результате могут развиться осложнения: портальная гипертензия, асцит, варикозное расширение вен пищевода, печеночная недостаточность [2].












