Новости
Резюме
Актуальность. Лечение окклюзионных поражений аортоподвздошного сегмента (АПС) представляется сложной задачей при сопутствующем мультифокальном поражении артерий жизненно важных органов: сердца, головного мозга, почек, висцеральных органов.
Цель исследования - научное обоснование комплекса мер по улучшению результатов открытого хирургического лечения больных с окклюзионным поражением АПС.
Материал и методы. Проведено проспективное нерандомизированное клиническое исследование хирургического лечения 134 пациентов с окклюзионным поражением АПС, которые в зависимости от тактики лечения были поделены на 2 группы: без коррекции и с коррекцией предикторов осложнений. 1-ю группу составили 70 пациентов с нестабильным течением окклюзии АПС, 2-ю группу - 64 пациента, которым при наличии показаний выполняли предварительную хирургическую коррекцию патологии коронарного русла и сонных артерий, реваскуляризацию тазового бассейна, предварительную коррекцию почечной недостаточности.
Результаты. Осложнения в 30-дневном послеоперационном периоде у больных 1-й группы привели к смертельному исходу в 4 (5,7%) случаях, во 2-й группе пациентов - в 1 (1,6%) случае. 5-летняя летальность у пациентов 1-й группы составила 5 (7,7%) случаев, во 2-й группе - 2 (3,3%) случая.
Заключение. Анализ конечных точек исследования показал, что на 30-дневную летальность повлияли коррекция предикторов осложнений и развитие полиорганной недостаточности; в 30-дневном послеоперационном периоде развитие инфаркта миокарда зависело от коррекции предикторов осложнений и фракции выброса, острая почечная недостаточность - от уровня креатинина крови; в 5-летнем послеоперационном периоде развитие инфаркта миокарда зависело от коррекции предикторов осложнений, острая почечная недостаточность - от уровня креатинина крови, а хроническая ишемия левой половины толстой кишки - от стеноза внутренней подвздошной артерии, ее анте- или ретроградного включения в магистральный кровоток при реконструкции АПС; на 5-летнюю выживаемость пациентов повлияли коррекция предикторов осложнений и развитие таких осложнений, как инфаркт миокарда и острая почечная недостаточность.
Ключевые слова:окклюзия аортоподвздошного сегмента, предикторы осложнений, открытая операция, летальность
Окклюзионные поражения аортоподвздошного сегмента (АПС) - одна из частых патологий, с которой встречается в своей практике сосудистый хирург. По данным нескольких крупных популяционных исследований, заболевание в зависимости от возраста имеет место в 0,9- 7% случаев, при этом клиническая картина варьирует от малосимптомного течения до критической ишемии нижних конечностей [1, 2].
Главной причиной развития окклюзии АПС является атеросклероз, для которого характерно мультифокальное поражение артериального русла [3]. С одной стороны, имеет место поражение АПС с прогрессированием ишемии нижних конечностей, с другой - сопутствующее поражение артерий жизненно важных органов: сердца, головного мозга, почек, висцеральных органов [1-3].
Открытые реконструктивные операции на АПС, с одной стороны, отличаются высокой травматичностью, с другой - при окклюзиях АПС, нередко приходится выполнять их по неотложным показаниям из-за высокого риска критической ишемии и гангрены конечности. К тому же только 30-60% больных можно отнести к возможным кандидатам для проведения малотравматичного стентирования артерий [4-5]. Другая часть больных из-за анатомических особенностей посадочных мест стента и артерий доступа могут быть пролечены только при помощи открытой реконструктивной операции.
В связи с этим лечение вышеуказанной категории больных представляется сложной задачей и требует выработки научно обоснованных подходов.
Цель нашего исследования - научное обоснование комплекса мер по улучшению результатов открытого хирургического лечения больных с окклюзионным поражением АПС.
В связи с поставленной целью были определены задачи по достижению конечных точек исследования. Первичная точка исследования - предикторы 30-дневной летальности, вторичные точки - предикторы госпитальных послеоперационных осложнений, осложнений в отдаленные сроки наблюдения и отдаленной выживаемости пациентов.
Дизайн исследования: проспективное нерандомизированное клиническое исследование.
Материал и методы
Расчет размера выборки выполняли при помощи программы PASS 2000 (версия 12.0.4).
Критерии включения: окклюзионные поражения АПС, оперативное вмешательство в плановом или срочном порядке, открытая реконструкция АПС.
Критерии исключения: юкста- и интерренальные окклюзии АПС, аневризма брюшной аорты, выполнение операции в экстренном порядке, эндоваскулярное протезирование АПС.
По данным отделения сердечно-сосудистой хирургии Университетского госпиталя НАО "Медицинский университет Семей", проанализированы результаты хирургического лечения 134 пациентов с окклюзионным поражением АПС с 2010 по 2018 г. В зависимости от тактики лечения пациенты поделены на 2 группы. 1-ю группу составили 70 пациентов с нестабильным течением окклюзии АПС, у которых при поступлении отмечалась клиническая картина критической ишемии нижних конечностей и угроза развития необратимых трофических нарушений вплоть до гангрены. В связи с этим пациентов данной группы оперировали по срочным показаниям, без предварительной хирургической коррекции гемодинамически значимых поражений коронарных и сонных артерий, реваскуляризации тазового бассейна, плановой коррекции почечной недостаточности. 2-ю группу составили 64 пациентов, которым при наличии показаний выполняли предварительную хирургическую коррекцию патологии коронарного русла и сонных артерий, реваскуляризацию тазового бассейна, предварительную коррекцию почечной недостаточности.
Время наблюдения - 30 дней после операции, в последующем интервал наблюдения (follow up) каждые 6 мес до 5 лет.
Средний возраст пациентов на момент операции в 1-й группе составил 64,2 года (Ме=65,0; Q1=58,8; Q3=69,4), во 2-й группе - 64,4 года (Ме=65,0; Q1=58,2; Q3=70,6). Мужчины превалировали во всех группах - 64 (91,4%) человек в 1-й группе и 60 (93,8%) человек во 2-й группе; женщины - 6 (8,6%) и 4 (6,2%) соответственно.
Статистическая обработка данных осуществлялась при помощи пакета статистических программ SPSS (версия 20). Количественные данные при нормальном распределении представлены в виде средней (М) и стандарного отклонения (SD). При отсутствии подчинения закону нормального распределения количественных данных, последние представлены в виде М - выборочное среднее, Ме - медиана, Q1 и Q3 - нижний и верхний квартили в качестве мер рассеяния. Качественные данные представлены в виде абсолютного числа и процента. Перед анализом количественных данных проводили их проверку на нормальность распределения (Q-Q-диаграмма, асимметрия, критерий Шапиро-Уилка для выборок до 50 наблюдений и Колмогорова-Смирнова для выборок свыше 50 наблюдений). При нормальном распределении для сравнения количественных данных применяли параметрические критерии (t-критерий Стьюдента, однофакторный дисперсионный анализ), в противном случае использовали непараметрические критерии (критерий Манна-Уитни, Краскела-Уоллиса). Для сравнения качественных признаков использовали χ2 Пирсона, точный критерий Фишера. Предикторы осложнений и летальность в 30-дневный период анализировали при помощи логистической регрессии, определения отношения шансов (ОШ) и 95% доверительного интервала (ДИ), а в 5-летнем послеоперационном периоде - при помощи регрессии Кокса с определением отношения рисков (ОР) и 95% ДИ соответственно. Анализ выживаемости проводили при помощи метода Каплана-Майера и Log-Rank-статистического критерия. За критерий статистически значимых различий принимали значения р<0,05.
В предоперационном периоде наряду с физикальным осмотром, определением ангиологического статуса и лабораторных показателей проводили различные инструментальные методы обследования. Целенаправленное внимание уделяли выявлению сопутствующих заболеваний и сочетанных поражений в других сосудистых бассейнах. С этой целью выполняли электрокардиографию (ЭКГ), эхокардиографию (ЭхоКГ), ультразвуковую допплерографию и дуплексное сканирование, мультиспиральную компьютерную томографию (МСКТ) ангиографию, коронарографию, по показаниям - транскраниальную допплерографию.
Причиной развития окклюзии АПС в исследуемых группах являлся атеросклероз.
Большинство больных в обеих группах имели различную сопутствующую патологию (табл. 1).
У пациентов 2-й группы в 51 (79,7%) случаях выполнена коронарография. По результатам последней хирургически значимых стенозов не выявлено у 17 (33,3%) пациентов, однососудистое поражение - в 6 (11,8%) случаях, двухсосудистое - в 16 (31,4%) случаях, трехсосудистое - у 12 (23,5%) пациентов.
Во 2-й группе больных выполняли этапные вмешательства. Очередность оперативного вмешательства зависела от клинического течения и выраженности сочетанных гемодинамически значимых поражений сосудистых бассейнов жизненно важных органов. Первым этапом выполняли хирургическую коррекцию коронарного русла или сонных артерий, затем после восстановительного периода заключительным этапом - реконструкцию АПС (табл. 2).
В обеих группах выполнялась реконструкция АПС по поводу окклюзии: в 1-й группе больных по срочным показаниям, во 2-й группе больных в плановом порядке (табл. 3).
Результаты
Результаты лечения пациентов изучены в 30- дневном и отдаленном 5-летнем послеоперационном периоде. Критериями оценки в 30-дневном послеоперационном периоде были восстановление кровотока в нижних конечностях, адекватность кровообращения в заинтересованных бассейнах, функция жизненно важных органов на фоне перенесенной операции, показатели анализов крови и мочи, восстановление перистальтики кишечника, состоятельность и заживление послеоперационных ран (табл. 4).
Осложнения в 30-дневном послеоперационном периоде у пациентов 1-й группы привели к смертельному исходу в 4 (5,7%) случаях. Причиной летального исхода стали острый инфаркт миокарда - 1 (1,4%) случай, острое нарушение мозгового кровообращения - 1 (1,4%); острая почечная недостаточность - 1 (1,4%) и полиорганная недостаточность - 1 (1,4%). Во 2-й группе ранние послеоперационные осложнения стали причиной смерти у 1 (1,6%) пациента с прогрессирующей полиорганной недостаточностью.
Среднее время дожития до 30-дневной летальности в 1-й группе составило 27,0 дней (95% ДИ 25,233-28,767), во 2-й группе - 28,859 дней (95% ДИ 28,081-29,637; Log Rank=7,823; p=0,043) (рис. 1).
Анализ осложнений в 30-дневный период выявил связь 30-дневной летальности с коррекцией предикторов осложнений (ОШ 0,041; 95% ДИ 0,003-0,513; р=0,013) и полиорганной недостаточностью (ОШ 6,458; 95% ДИ 3,551-11,569; р=0,001). На развитие инфаркта миокарда влияли коррекция предикторов (ОШ 0,068; 95% ДИ 0,005-0,443; р=0,004) и фракция выброса (ОШ 0,911; 95% ДИ 0,859-0,965; р=0,003). Острая почечная недостаточность зависела от уровня креатинина крови (ОШ 0,076; 95% ДИ 0,024-0,352; р=0,003). Анализ других осложнений в 30-дневный послеоперационный период не выявил их связи с возможными факторами риска.
В отдаленном периоде изучали функционирование сосудистого протеза и кровоснабжение нижних конечностей, состоятельность анастомозов и послеоперационных ран, состояние кровообращения в артериальных бассейнах жизненно важных органов. Отдаленные результаты в сроки от 6 мес до 5 лет прослежены у 65 (92,9%) пациентов 1-й группы и 61 (95,3%) пациента 2-й группы (табл. 5).
Осложнения в отдаленном периоде у 1-й группы привели к летальному исходу у 5 (7,7%) пациентов: причиной смерти в 2 (3,1%) случаях стал инфаркт миокарда, 1 (1,5%) больной скончался от инсульта, в 1 (1,5%) случае пациент умер от онкологической патологии, в 1 (1,5%) случае причиной смерти стала прогрессирующая почечная недостаточность. Во 2-й группе фатальные осложнения в отдаленном периоде развились у 2 (3,3%) пациентов: в 1 (1,6%) случае причиной стал инфаркт миокарда и у 1 (1,6%) - острая почечная недостаточность.
Выживаемость в 5-летнем периоде в 1-й группе составила 56,1 (95% ДИ 52,7-59,5) мес, во 2-й группе 58,4 (95% ДИ 56,3-60,0) мес (Log Rank=0,834; р=0,361) (рис. 2).
В 5-летнем периоде выживаемость зависела от коррекции предикторов осложнений (ОР 0,146; 95% ДИ 0,108-0,456; р=0,034), развития таких осложнений, как инфаркт миокарда (ОР 3,509; 95% ДИ 1,153-5,945; р=0,005) и острая почечная недостаточность (ОР 5,731; 95% ДИ 2,371-10,964;р=0,001). Инфаркт миокарда в отдаленном периоде зависел от коррекции предикторов осложнений (ОР 1,145; 95% ДИ 1,052-1,246; р=0,002), острая почечная недостаточность - от уровня креатинина крови (ОР 3,017; 95% ДИ 1,921-8,739; р=0,001), а хроническая ишемия левой половины толстой кишки - от стеноза внутренней подвздошной артерии (ВПА) (ОР 1,012; 95% ДИ 1,003-1,019; р=0,018), анте- (ОР 0,060; 95% ДИ 0,017-0,218; р=0,001) или ретроградного (ОР 0,201; 95% ДИ 0,067-0,666; р=0,010) включения ВПА в магистральный кровоток при реконструкции АПС.
Обсуждение
Проведенный анализ хирургического лечения больных с окклюзией АПС показывает, что результаты лечения данной категории больных во многом зависят от степени выраженности сочетанных поражений артериального русла жизненно важных органов: сердца и головного мозга, функции почек. Безупречно выполненная операция по поводу окклюзии АПС может осложниться острым нарушением кровообращения в бассейне коронарных и мозговых артерий с развитием фатального исхода. В связи с этим оптимизация хирургической тактики у больных с сочетанием окклюзии АПС, ишемической болезни сердца (ИБС), нарушением мозгового кровообращения и функции почек является одним из актуальных направлений современной ангиохирургии.
Пациенты обеих групп изначально были сопоставимы по сопутствующей патологии, в том числе по наличию ИБС, нарушению мозгового кровоснабжения, перенесенным инфаркту и инсульту, нарушению функции почек. Нестабильное течение окклюзии АПС у 1-й группы с наличием клинической симптоматики критической ишемии и угрозы развития необратимых трофических нарушений являлось показанием для срочного оперативного вмешательства, что позволило нам сравнить две тактики открытого хирургического лечения окклюзии АПС: без коррекции предикторов осложнений в 1-й группе, оперированных по срочным показаниям, и с предварительной коррекцией предикторов осложнений у пациентов 2-й группы, которым заблаговременно выполняли этапные оперативные вмешательства по поводу ИБС, гемодинамически значимых поражений сонных артерий, проводили коррекцию нарушений функции почек, а заключительным этапом выполняли реконструкцю АПС.
При реконструкции АПС во 2-й группе акцентировали внимание на реваскуляризацию и улучшение кровоснабжения по ВПА к органам малого таза и левой половине толстой кишки: в 6 (9,4%) случаях выполнена реваскуляризация ВПА по методике клиники, в 7 (10,9%) случаях обеспечен антеградный кровоток по ВПА путем аортоподвздошно-бедренной реконструкции. Данные меры позволили уменьшить развитие хронического ишемического колита с 4,6 до 1,6% (р=0,257).
Нужно отметить, что во 2-й группе в 30-дневном послеоперационном периоде удалось предотвратить развитие инсульта, уменьшить количество случаев инфаркта миокарда, осложнений со стороны почек, легких, полиорганной недостаточности по сравнению с 1-й группой. Несмотря на то что по отдельности не выявлено различий по частоте системных осложнений между группами, в целом, в 30-дневном послеоперационном периоде количество системных осложнений в 1-й группе было значимо больше по сравнению со 2-й группой (р=0,004), что также повлияло на лучшие показатели 30-дневной летальности во 2-й группе пациентов (Log Rank=7,823; р=0,043). В отдаленном послеоперационном периоде количество системных осложнений также было больше в 1-й группе по сравнению со 2-й группой (р=0,011), однако различий в 5-летней выживаемости не выявлено (Log Rank=0,834; р=0,361).
Любое осложнение так или иначе связано с определенной причиной или предиктором. В проведенном исследовании мы постарались проанализировать причинно-следственную связь между определенными предикторами и развитием осложнения у больных после открытой операции по поводу АПС. Для каждого осложнения в соответствии с патогенезом и данными литературы были определены соответствующие факторы риска или предикторы [6-8], с которыми провели одно- и многофакторный регрессионный анализ. Для выявления влияния группы пациентов на анализируемое событие или летальность создали переменную "Коррекция предикторов" для выделения больных 2-й группы, так как им выполняли предварительную хирургическую коррекцию патологии коронарных и сонных артерий, коррекцию почечной недостаточности, реваскуляризацию тазово-висцерального бассейна.
Заключение
Таким образом, на основании проведенного сравнительного анализа конечных точек исследования при применении двух тактик открытого хирургического лечения окклюзии АПС на фоне сопутствующей патологии со стороны жизненно важных органов можно заключить следующее:
1) на 30-дневную летальность повлияли коррекция предикторов осложнений и развитие полиорганной недостаточности;
2) в 30-дневном послеоперационном периоде развитие инфаркта миокарда зависело от коррекции предикторов осложнений и фракции выброса, острая почечная недостаточность - от уровня креатинина крови;
3) в 5-летнем послеоперационном периоде развитие инфаркта миокарда зависело от коррекции предикторов осложнений, острая почечная недостаточность - от уровня креатинина крови, а хроническая ишемия левой половины толстой кишки - от стеноза ВПА, антеградного или ретроградного включения ВПА в магистральный кровоток при реконструкции АПС;
4) на 5-летнюю выживаемость больных повлияли коррекция предикторов осложнений и развитие таких осложнений, как инфаркт миокарда и острая почечная недостаточность.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Распространенность нейрофиброматоза первого типа (НФ1) составляет примерно 1 случай на 3000 человек, однако эта цифра заметно варьирует в зависимости от страны и в России составляет 1 случай на 7 812 человек. Ожидаемая продолжительность жизни людей с нейрофиброматозом первого типа сокращена на ~ 8–21 лет, а причина их смерти чаще всего связана со злокачественными новообразованиями.
НФ1 — генетически обусловленное заболевание с аутосомно-доминантным типом наследования, что означает, что все носители герминативных мутаций в гене 17q11.2 заболеют НФ1. Однако проявления этого заболевания крайне вариабельны и могут различаться даже среди членов одной семьи, имеющих идентичную мутацию. К слову, различных мутаций, обусловливающих заболевание, довольно много (>3000), что связано с большим размером гена (более 60 экзонов) и многообразием типов мутаций (транслокации, делеции, инверсии и точковые мутации), которые могут происходить в этой области — это усложняет генетическую диагностику. Последнюю проводят на материале ДНК лимфоцитов периферической крови и/или опухолевом материале, исключение — сегментарный нейрофиброматоз (иногда называемый нейрофиброматозом V типа), когда поражение затрагивает только один сегмент тела пациента. В последнем случае материалом для диагностики может служить только опухолевый материал.
.
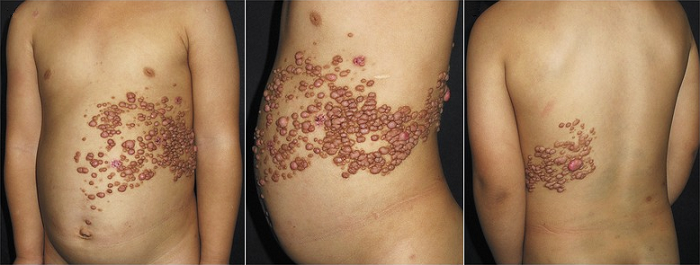
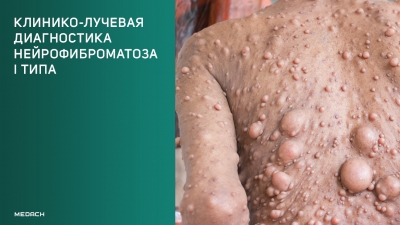
Рисунок 1 | Сегментарный нейрофиброматоз. Множественные нейрофибромы, расположенные в пределах одного или нескольких дерматомов.
Ген 17q11 кодирует белок нейрофибромин, являющийся супрессором опухолевого роста. Нейрофибромин продуцируется в нервных клетках и специализированных клетках нейроглии (олигодендроциты и шванновские клетки) и в норме подавляет протоонкоген RAS, ускоряя его переход в неактивную форму. Невозможность продуцировать функционирующий нейрофибромин приводит к увеличению роста и выживаемости клеток.
Клинические проявления
Пигментные нарушения
Пятна «кофе с молоком» являются одним из наиболее частых кожных симптомов НФ1. Эти пятна могут увеличиваться в размерах и количестве, а также с возрастом приобретать более темную окраску. Начиная с периода новорожденности могут появляться скопления мелких пигментных пятен (веснушек) в подмышечных впадинах, паховой области и в других складках кожи.
Нейрофибромы
Доброкачественные новообразования, характерные для НФ1. Встречаются кожные (подкожные), интраневральные, плексиформные и диффузные нейрофибромы.
.
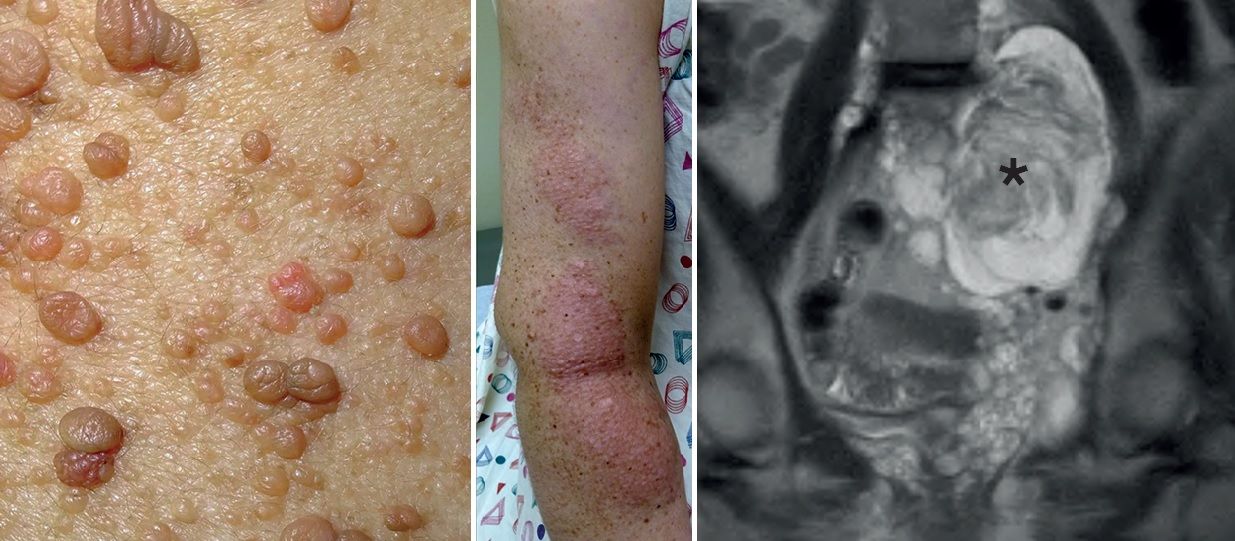
Рисунок 2 | Слева направо: кожные нейрофибромы; интраневральные нейрофибромы по ходу периферического нерва; крупная интраабдоминальная плексиформная нейрофиброма (звездочка).
Кожные нейрофибромы происходят из дермальных клеток-предшественниц, могут быть болезненными или безболезненными узелковыми образованиями, описан симптом «дверного звонка»: при надавливании нейрофиброма полностью проваливается в кожу.
Интраневральные и плексиформные нейрофибромы — это опухолевые образования из оболочек периферических нервов и нервных сплетений. У мышей с двухаллельной потерей гена НФ1 в шванновских клетках удалось смоделировать нейрофибромы, схожие с такими у людей с НФ1. Как и человеческие плексиформные нейрофибромы, опухоли у мышей состояли из различных типов клеток, в том числе тучных клеток, макрофагов, фибробластов, нейронов и шванновских клеток.
Нейрофибромы могут перерождаться в злокачественные опухоли из оболочек нервов, причем наибольший риск представляют плексиформные нейрофибромы, особенно плечевого и пояснично-крестцового сплетений. Также риск перерождения повышен у пациентов с лучевой терапией в анамнезе или с наличием семейной истории малигнизации.
Характерный симптом нейрофибром — образование смещается только латерально, но не вверх-вниз (так как оно «сидит» на нервном стволе). Нейрофибромы могут сдавливать периферический нерв, приводя к потере его функции.
Скелетные аномалии
Для нормального функционирования костной ткани требуется скоординированное взаимодействие между резорбирующими (остеокласты) и костеобразующими (остеобласты) клетками. Использование мышиной модели показало нарушения функции остеобластов (увеличение продукции пирофосфата, снижение костного морфогенетического протеина 2, который способствует дифференциации остеобластов) у мутантных по НФ1 гену мышей. В результате у пациентов отмечается нарушение минерализации костей, дугообразные деформации большеберцовых костей, кифотические и сколиотические деформации, деформации грудной клетки, псевдоартрозы крупных суставов, дисплазия клиновидных костей.
Глиома зрительного тракта
Глиомы — доброкачественные опухоли из зрительного нерва и других частей зрительного анализатора. Расположение может быть любым (орбитальным, интраканальным, интракраниальным — последнее иногда разделяют на пре-, постхиазмальное и хиазмальное), возможно множественное поражение, симметричное расположение опухолей нехарактерно. Показана значительная зависимость роста опухоли от опухолевого окружения, которое представлено в основном клетками нейроглии. Последние влияют на пролиферацию опухолевых клеток путем секреции цитокинов, а также нейротоксинов, которые повреждают аксоны зрительного нерва, приводя к нарушению остроты зрения. Это дает надежду, что в будущем таргетная терапия, нацеленная на опухолевое окружение, сможет замедлять рост глиом зрительного нерва. Данное новообразование редко бывает причиной смерти, но значительно влияет на качество жизни больных. Девочки болеют в 5–10 раз чаще мальчиков.
Кроме того, у больных НФ1 чаще, чем в среднем в популяции, встречаются другие типы опухолей головного мозга (астроцитомы, глиомы).
Другие проявления
Среди опухолевых заболеваний встречаются феохромоцитома, гамартомы радужной оболочки (узелки Лиша).
Часто встречается задержка умственного развития.
Кумулятивный риск злокачественного образования к 50 годам у лиц с нейрофиброматозом типа 1 повышается на 20–39 %, с риском развития рака в течение жизни ~ 60 %.
Кроме того, люди с нейрофиброматозом типа 1 имеют исключительно высокий риск развития злокачественных опухолей головного мозга (приблизительно в 40 раз выше риск развития глиомы высокой степени злокачественности), эндокринного рака (более чем в 74 раза повышен риск развития рака надпочечников), злокачественных новообразований периферических нервов (> в 1000 раз повышенный риск развития) и рака молочной железы.
Дети с нейрофиброматозом типа 1 имеют повышенный риск лейкемии, острого лимфоцитарного лейкоза, неходжкинской лимфомы.
Кроме того, некоторые исследования подтверждают повышенный риск развития рассеянного склероза, эпилепсии, макроцефалии, гидроцефалии.
.
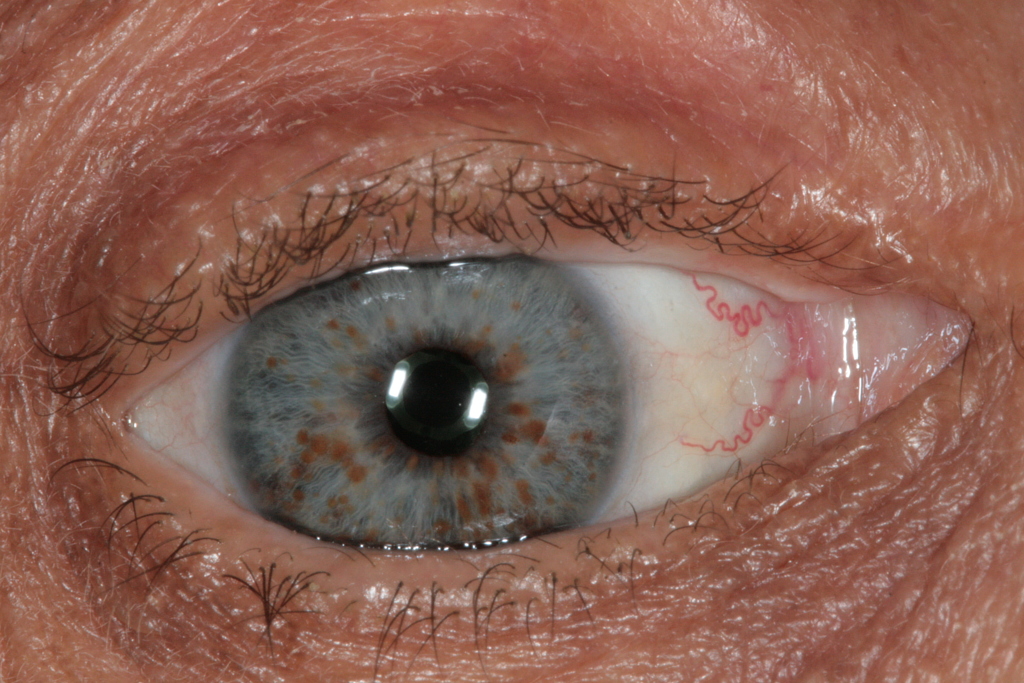
Рисунок 3 | Узелки Лиша.
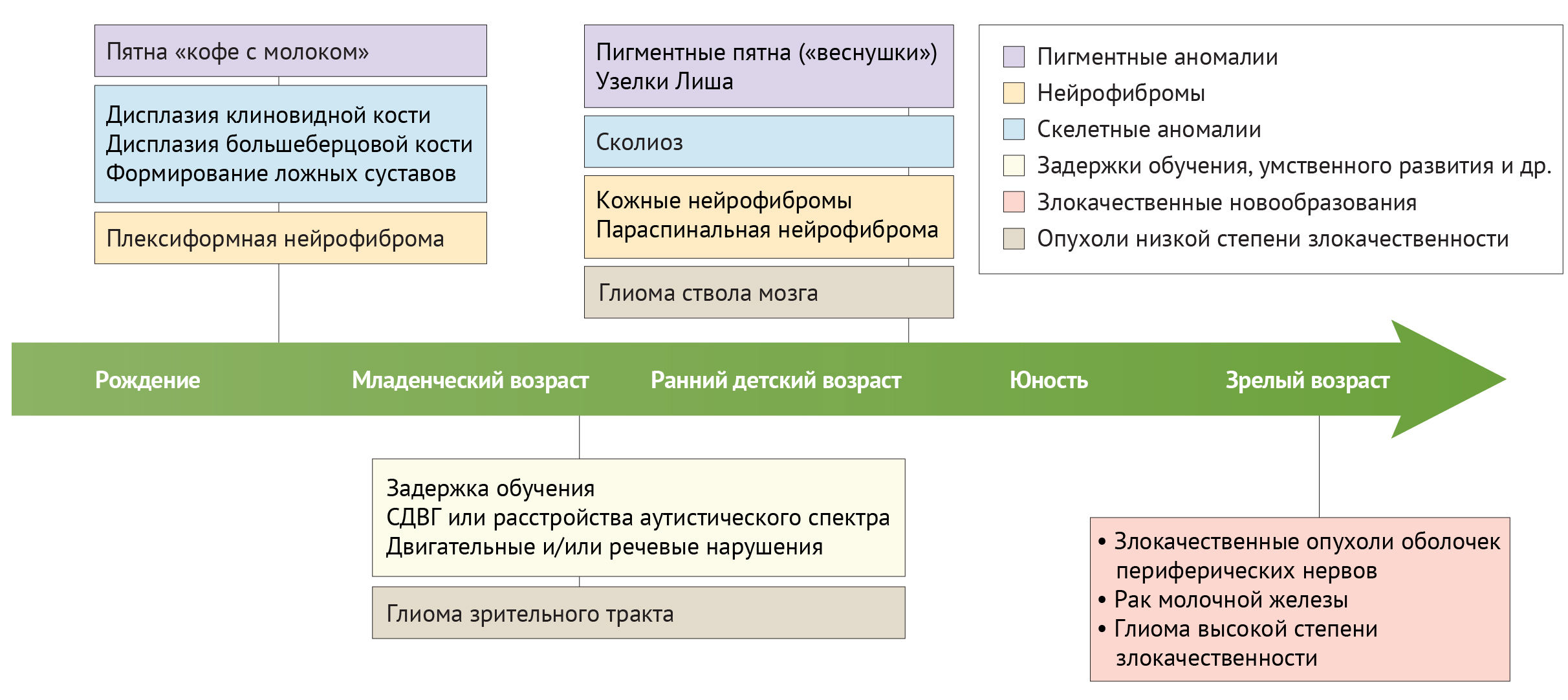
Рисунок 4 | Проявления симптомов нейрофиброматоза первого типа в зависимости от возраста пациента.
Критерием диагностики НФ первого типа считают наличие двух или более признаков (согласно конференции Национального института здоровья по нейрофиброматозу, США, 1988):
- ≥ 6 пятен цвета «кофе с молоком» диаметром > 5 мм в препубертатном периоде или диаметром 15 мм в постпубертатном периоде;
- ≥ 2 нейрофибромы любого типа либо одна плексиформная нейрофиброма;
- Мелкие пигментные пятна в подмышечных и паховых областях, напоминающие веснушки (симптом Кроува);
- Глиома зрительного нерва;
- ≥ 2 узелка Лиша (гамартом радужной оболочки);
- Костные изменения: дисплазия крыла клиновидной кости, истончение кортикального слоя трубчатых костей с псевдоартрозом или без него;
- Наличие НФ типа I у родственников первой степени родства.
Лучевые проявления нейрофиброматоза
Со стороны ЦНС
Глиома зрительного тракта может определяться на КТ (особенно при исследованиях с малой толщиной среза) как веретенообразное или экзофитное расширение зрительного нерва, может также наблюдаться извитость его хода. Однако более чувствительной методикой является МРТ. Глиома проявляет себя высоким в Т2ВИ МР-сигналом (может определяться тонкая гипоинтенсивная полоска по периферии — отодвинутая опухолью твердая мозговая оболочка) и МР-сигналом от изо- до гипоинтенсивного на Т1ВИ; Такие опухоли часто накапливают контрастный препарат.
Дифференциальная диагностика глиомы зрительного нерва в первую очередь проводится с менингиомой: для последней характерно наличие кальцинатов и симптом «трамвайных рельс», когда края сохранного зрительного нерва виднеются в виде параллельных полос на фоне опухоли). Глиому хиазмальной области нужно дифференцировать с ганглионглиомой, менингиомой, астроцитомой или глиомой гипоталамуса и др.
Существует классификация распространенности глиом зрительного тракта по Dodge:
1 стадия: в процесс вовлечен только зрительный нерв.
2 стадия: вовлечение хиазмы.
3 стадия: вовлечение гипоталамуса и/или других прилежащих структур.
.
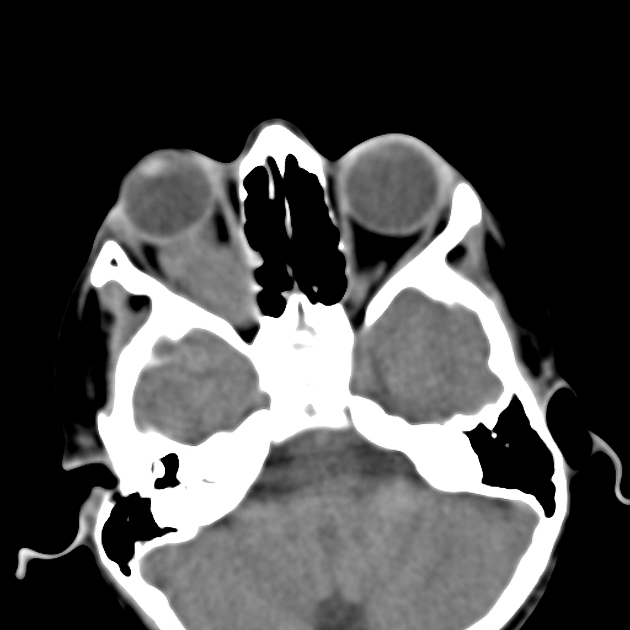
Рисунок 5 | На аксиальном КТ-скане определяется неравномерно расширенный правый зрительный нерв (на скане — слева).
.
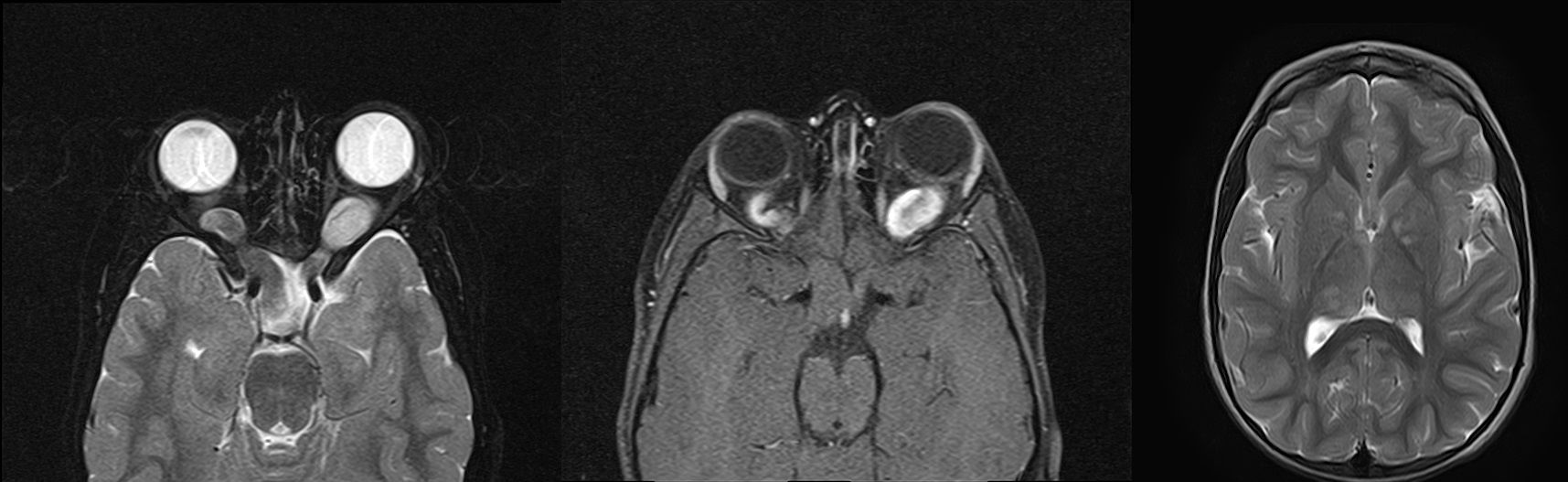
Рисунок 6 | Двусторонние глиомы зрительных нервов у пациента с НФ1. Определяется двустороннее расширение зрительного нерва с повышением МР-сигнала от него на Т2ВИ (1) и интенсивным накоплением контрастного препарата (2). У этого же пациента определялись зоны повышения МР-сигнала в Т2ВИ без четких контуров, масс-эффекта или отека прилежащей паренхимы мозга, расположенные в базальных ядрах и таламусе (3).
Глиомы ствола мозга
Составляют примерно 8–10 % от общего числа новообразований ЦНС при НФ1. Средний возраст пациентов составляет 8 лет. Чаще поражается мозжечок, следующими по частоте являются Варолиев мост и промежуточный мозг. Следует отмечать сопутствующие гидроцефалию и вклинение мозга. Опухоли выглядят гиперинтенсивными на Т2ВИ, обычно гетерогенно накапливают контраст. Чтобы не пропустить слабоинтенсивное контрастное усиление, возможно использование субтракции.
.
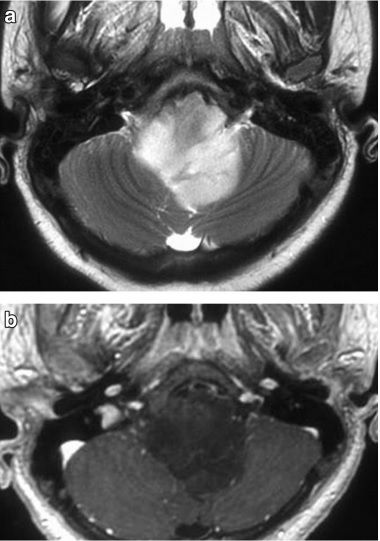
Рисунок 7 | Глиома ствола мозга. В области мозжечка определяется гиперинтенсивное в Т2ВИ (а) образование, которое на постконтастных Т1ВИ (b) демонстрирует слабое негомогенное накопление контраста.
Фокальные области гиперинтенсивности (FASI)
Обнаруживаются у примерно 80 % пациентов с НФ1 и представляют собой области гиперинтенсивного МР-сигнала на Т2ВИ и FLAIR, расположенные в базалных ядрах, таламусе, стволе мозга, мозжечке и субкортикальном белом веществе. Морфологически представляют собой участки миелинопатии с увеличением вакуолей. Корреляция данных изменений с клиникой до конца не понятна.
.
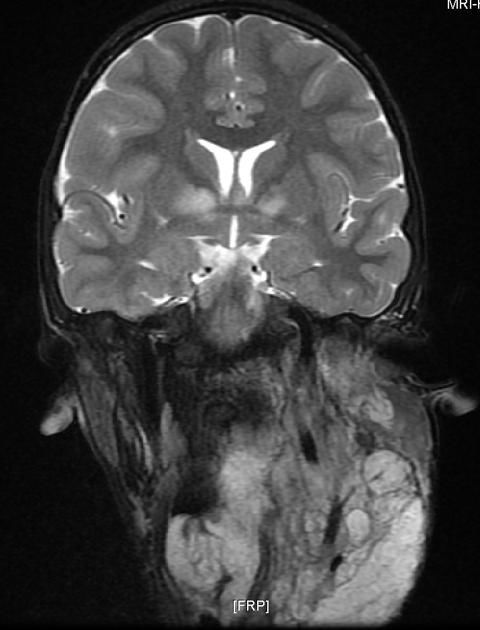
Рисунок 8 | Определяются асимметричные области гиперинтенсивного МР-сигнала в Т2 в базальных ядрах с обеих сторон. Также обращает на себя внимание гиперинтенсивное образование по левой поверхности шеи и головы — плексиформная нейрофиброма.
Другие проявления со стороны ЦНС, области головы и шеи
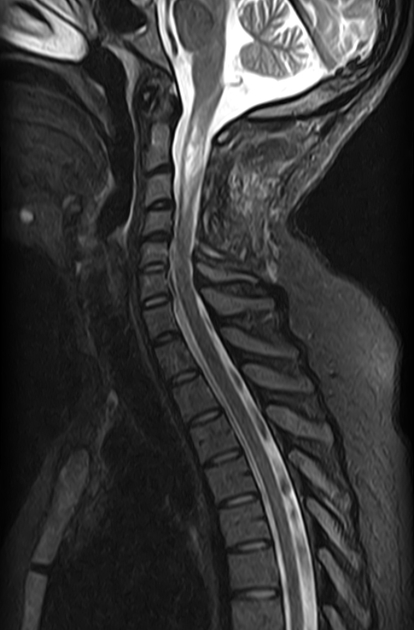
Рисунок 9 | STIR шейного отдела позвоночника в сагиттальной проекции. Определяется гиперинтенсивное интрамедуллярное образование с нечеткими краями — астроцитома спинного мозга. У пациентов с НФ1 повышен риск возникновения злокачественных новообразований ЦНС.
.
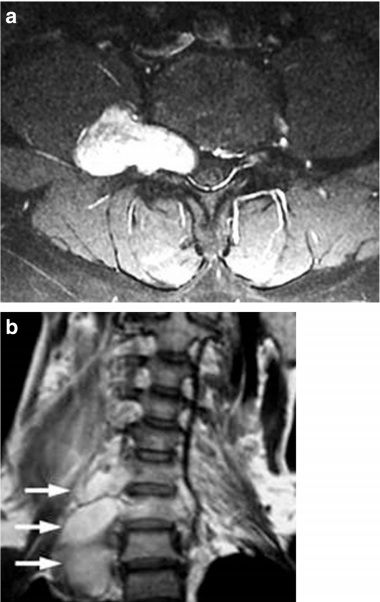
Рисунок 10 | Аксиальный Т2Fs (а) и корональный Т2ВИ (b) у пациента с НФ1. Определяются неравномерное расширение и гиперинтенсивность МР-сигнала от спинномозговых нервов, обусловленные интраневральными нейрофибромами.
.
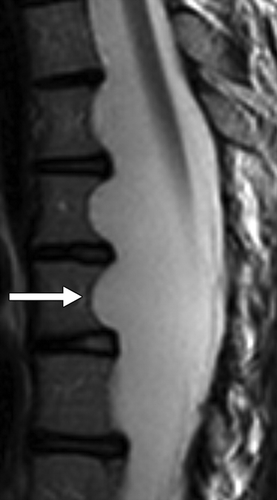
Рисунок 11 | Сагиттальный Т2ВИ поясничного отдела позвоночника. Определяется эктазия (расширение) дурального мешка.
.
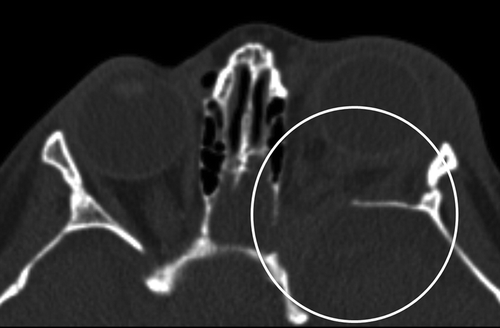
Рисунок 12 | Аксиальный КТ-скан орбит. Определяется дисплазия левого крыла клиновидной кости (кружок); увеличена верхняя орбитальная щель. Нередко в этой области возникают нейрофибромы, приводя к проптозу на стороне поражения.
.
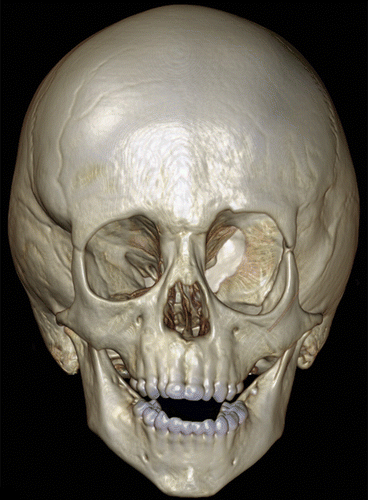
Рисунок 13 | 3D-реконструкция КТ костей черепа. Наблюдается дисплазия левого крыла клиновидной кости.Также обращает на себя внимание увеличение мозгового черепа.
Костно-мышечные проявления НФ1
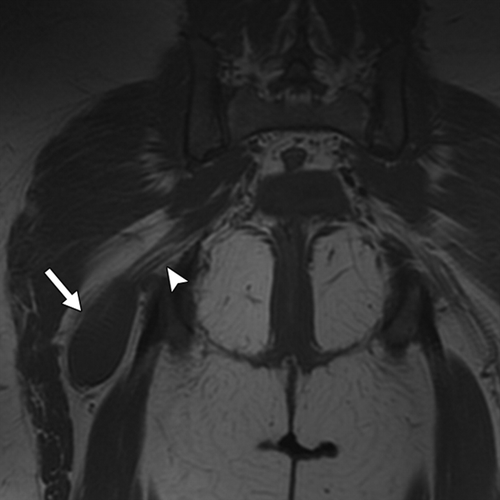
Рисунок 14 | Аксиальный Т1ВИ области таза. В области правого седалищного нерва определяется округлое образование изоинтенсивного с мышцами МР-сигнала — солитарная интраневральная нейрофиброма.
.
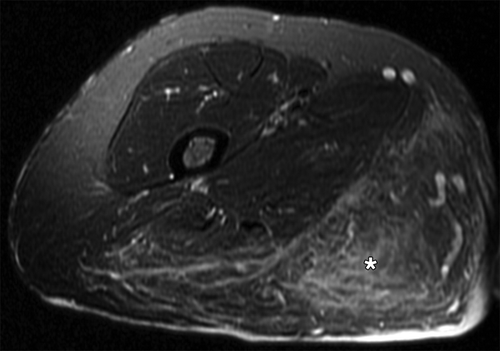
Рисунок 15 | Аксиальный PDFs скан правого бедра. Определяется область гиперинтенсивного сигнала в подкожной жировой клетчатке (звездочка) — диффузная нейрофиброма.
.
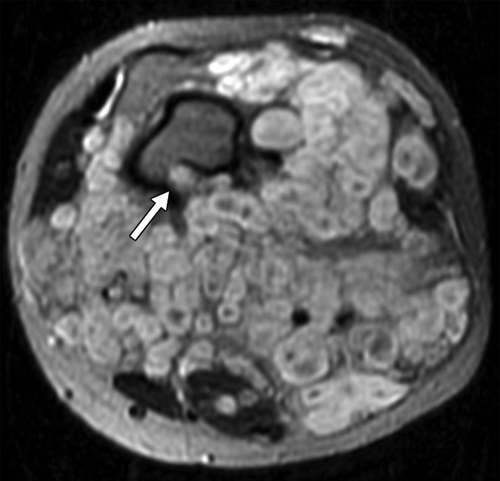
Рисунок 16 | Аксиальное Т2ВИ левого бедра. Множественные узелки гиперинтенсивного МР-сигнала с гипоинтенсивной областью в центре (сиптом мишени). Обратите внимание на масс-эффект и эрозирование кортикального слоя кости (стрелка). Плексиформная нейрофиброма.
.
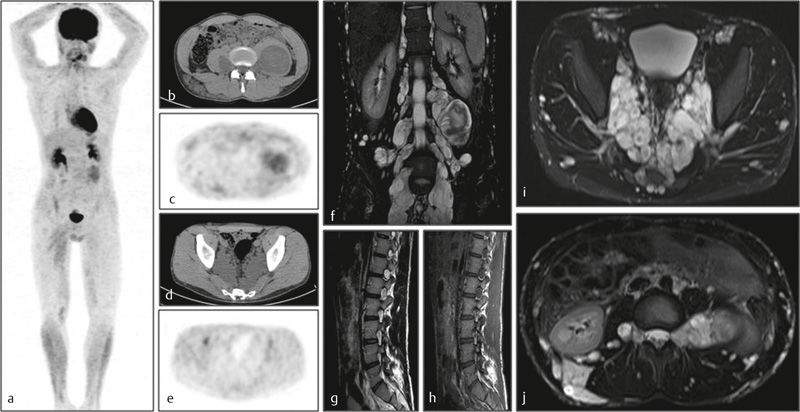
Рисунок 17 | Пациентка 20 лет с множественными нейрофибромами. 18F-FDG ПЭТ (а) не показала очагов патологического метаболизма глюкозы; b,c — нейрофиброма левой подвздошно-поясничной мышцы с умеренным повышением метаболизма; d,e — гиперденсная нейрофиброма левой подвздошной области без повышения метаболизма; f-j — множественные спинальные нейрофибромы с гиперинтенсивным МР сигналом в Т2ВИ.
.
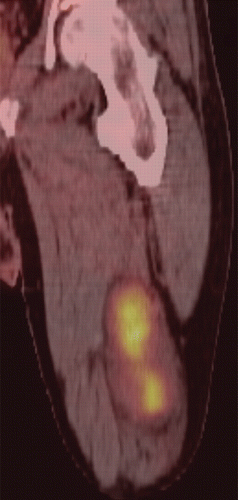
Рисунок 18 | 18F-FDG ПЭТ/КТ изображение показало объемное новообразование с интенсивным повышением метаболизма — злокачественная опухоль из оболочки периферического нерва. 18F-FDG ПЭТ является наиболее чувствительным методом дифференциальной диагностики злокачественных опухолей из оболочек периферических нервов с нейрофибромами.
.
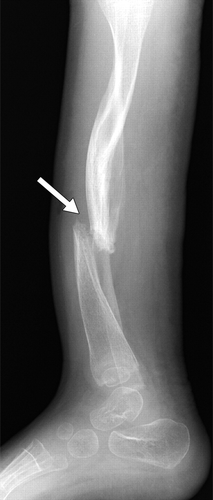
Рисунок 19 | Ложный сустав и дугообразная деформация обеих берцовых костей.
.
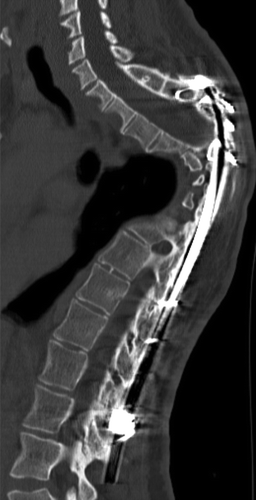
Рисунок 20 | КТ в сагиттальной реконструкции. Выраженная кифотическая деформация, дистрофический сколиоз. Определяются артефакты от металлической фиксирующей конструкции.
Скорая помощь в Польше впервые появилась в городе Краков в 1891 году, с созданием Краковской ассоциации добровольных спасателей. Сейчас скорая помощь Польши это разветвленная сеть подстанции, восемь тысяч бригад и диспетчерский центр, функционирующий на основе единой Национальной системы поддержки государственного аварийного медицинского командования. Вызвать скорую набрав номер 999 со стационарного или 112 с мобильного телефона.
Скорая в Польше не похожа на нашу, вернее похожа только тем, что вызов может быть только в экстренной форме, то есть, только при угрозе жизни, и всё.
Поводы для вызова скорой в Польше:
- нарушение сознания;
- нарушение дыхания;
- судороги;
- острая, внезапная боль в грудной клетке;
- нарушение сердечного ритма;
- острая боль в животе или спине (в поясничном отделе);
- острое психическое расстройство;
- острое отравление или рвота с кровью;
- массивное кровотечение;
- ДТП.
Это почти как у нас в 388н, когда вызов формируется с поводами в экстренной форме.
Диспетчер после принятия решения о направлении к бригады скорой, сообщает коронную фразу: «Звонок принят» – это означает что бригада выехала.
Если после опроса диспетчер примет решение не направлять бригаду, то врач даст рекомендации к какому специалисту следует обращаться за помощью и по какому номеру звонить. Если преувеличить жалобы, обмануть диспетчера, и бригада приедет на вызов, а там окажется что угрозы жизни нет, то такого пациента ждет штраф. Все строго у них, не забалуешь. Поэтому любители беспричинных вызовов будут вынуждены оплатить штраф в размере от 500 до 1500 злотых (от 8000 руб. до 24000 руб.).
Головная боль или температура это не причина для вызова польской скорой. К примеру, в новогоднее дежурство с 31-го декабря 19 года на 1-е 20 года в городе Краков (800 тыс. жителей) было выполнено 250 вызовов, большинство из них было связано с употреблением алкоголя, а пациентам не требовалась медицинская помощь. Всем им придет счет.
Бригады в Польше скорой делятся на категории:
- S – специализированные. Бригада состоит из 3-х человек, один из которых врач. Эти бригады выезжают на самые сложные вызовы, где нужна экстренная и квалифицированная помощь профессионалов.
- P - базовые безврачебные бригады. На бригаду заступают 2 фельдшера. Бригады выезжают на вызовы, где помощь врача не нужна.
- T — транспортные бригады. Предназначены для перевозки пациента (из стационара в стационар, из стационара домой), который не нуждается в экстренной медицинской помощи.
В польской системе есть также машины скорой помощи POZ (базовая медицинская помощь) и NPL (ночная медицинская помощь). Эти машины скорой помощи чаще всего используются семейными врачами для посещения на дому людей, которые не могут самостоятельно попасть в поликлинику, и их состояние достаточно стабильно, чтобы не угрожать их жизни. Машины скорой помощи NPL, с другой стороны, как следует из их названия, дежурят в будние дни и 24 часа в сутки в праздничные дни.
В Польше абсолютно все водители пропускают скорую помощь. Почему так? Огромные штрафы или вовсе лишение ВУ при неоднократном нарушении. Дешевле будет разбить бампер на своем автомобиле заехав на тротуар, чем не пропустить автомобиль со спецсигналами
Среднее время прибытия бригады не превышает 8 минут в городе и 15 минут за городом. В деревнях ситуация с доездами похуже, время прибытия может составлять 45 минут.
На всех автомобилях установлена система GPS для отслеживания бригады в реальном времени, а так же для приоритетного направления к месту вызова. Так же у диспетчера имеется возможность направить на вызов вертолет (LPR) – Воздушная спасательная служба. Авиатранспорт расположен по всей территории Польши на 22 постоянных площадках. На линию выходит 34 флота, в основном это модель Eurocopter EC135. Вертолеты работают в обычное время с 7 до 20, или с восхода солнца до заката.
Марики автомобилей скорой которые я встречал это мерседес, фиат и пежо. Световая индикация у всех одинаковая, и что хорошо, она есть на решетке радиатора, но по нашему ГОСТу так делать не положено, хотя на дороге в заднее зеркало она заметнее, привлекает внимание.
Российские дипломы фельдшеров с 2019 года более в Польше не признаются (если диплом получен после сентября 2006 года), необходимо сдать экзамен в местном Минздраве для получения права на работу, а так же экзамен по польскому языку.
Сравнивая оказание скорой помощи, отмечу что у нас можно вызвать бригаду не только при угрозе жизни, а так же избежать штрафа при преувеличении симптомов во время вызова. В общем, не познать польским бригадам наших самых дорогих и самых активных пользователей службы. А нам, лучше не болеть!