Новости
Несмотря на значительные успехи в развитии акушерской помощи, частота преждевременных родов остается высокой. Данная проблема является не только медицинской, но и социальной, связанной с решением задач по улучшению качества последующей жизни детей, родившихся недоношенными и сопряженными материально-экономическими затратами. Врачебная тактика при преждевременных родах зависит от гестационного срока, клинической картины, целостности плодного пузыря. Она включает в себя, помимо прочего, повышение вероятности рождения жизнеспособного плода (профилактика респираторного дистресс-синдрома плода). С этой целью используются кортикостероиды. Несмотря на их широкое повсеместное применение, в настоящее время нет единого мнения относительно выбора конкретного кортикостероида, дозы, частоты, времени использования и способа введения.
Кортикостероиды действуют внутриклеточно, взаимодействуя со специфическими рецепторами в цитоплазме клеток. При этом рецептор «активируется», что приводит к его конформационным изменениям. Образовавшийся комплекс стероид-рецептор проникает в ядро клетки и, связываясь с ДНК, регулирует транскрипцию определенных генов, благодаря чему происходит стимуляция образования специфических иРНК, которые влияют на синтез белков и ферментов. Все это приводит к глюкокортикоидным эффектам, включая глюконеогенез, протеолиз, липолиз, подавление иммунных реакций и минералокортикоидным эффектам, включая гипертонию, удержание натрия и воды и потерю калия. В фетальном легком действие кортикостероидов приводит к увеличению продуцирования белка, биосинтезу фосфолипидов и появлению сурфактанта.
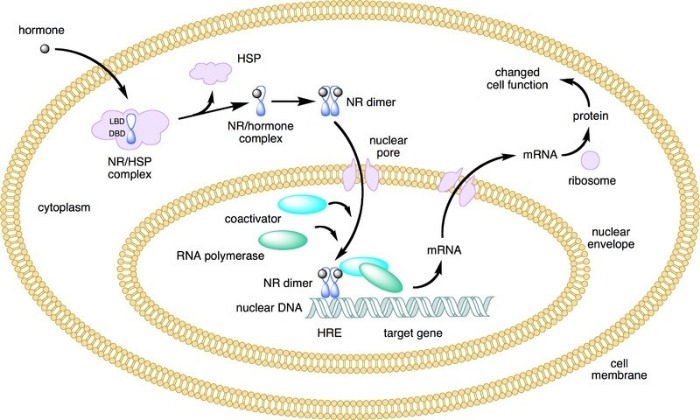
G. C. Liggins в 1969 году продемонстрировал, что легкие ягнят, рожденных преждевременно, становятся функционально зрелыми после антенатального введения кортикостероидов. Далее следовали несколько клинических испытаний для оценки влияния кортикостероидов у людей с целью ускорения созревания легких плода.
Кокрейновский обзор «Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth» показал, что однократный курс антенатальных кортикостероидов значительно уменьшил частоту респираторного дистресс-синдрома плода (Roberts, 2006). Другими полезными результатами были снижение неонатальной смертности, цереброваскулярных кровоизлияний, некротизирующего энтероколита, инфекционной заболеваемости и потребности в респираторной поддержке и интенсивной терапии новорожденных. Для материнского организма использование кортикостероидов не показало увеличения риска летального исхода, хориоамнионита или послеродового сепсиса (Roberts, 2006). Кортикостероиды стали стандартом для женщин с риском преждевременных родов до 34 недель беременности во многих странах.
В настоящее время в качестве антенатальных кортикостероидов в клинической практике применяются бетаметазон и дексаметазон. Они оба способны проникать через плаценту в их активной форме и иметь сопоставимые свойства. Оба препарата имеют категорию С по FDA, то есть применяются, если ожидаемый эффект терапии превышает потенциальный риск для плода. По результатам 12 крупных рандомизированных исследований было сделано заключение о том, что дексаметазон ассоциируется с более низким риском внутрижелудочкового кровоизлияния, по другим статистически важным показателям, таким как перинатальная смертность и развитие респираторного дистресс-синдрома, значимых различий не наблюдалось.
По способу введения пероральный; в отдельных небольших исследованиях уступал внутримышечному, так как происходило увеличение частоты неонатального сепсиса. Крупных рандомизированных исследований проведено не было.
В режиме дозирования между 12-часовыми и 24-часовыми интервалами никаких различий в материнских или неонатальных исходах не было отмечено. Отдельным плюсом в пользу 12-часового интервала является сокращение пребывания матерей в лечебно-профилактических учреждениях.
В заключение можно сказать, что курсовое применение кортикостероидов безоговорочно улучшает исход преждевременных родов. Дексаметазон имеет некоторые преимущества по сравнению с бетаметазоном в связи с улучшением биофизических показателей, уменьшением количества внутрижелудочковых кровоизлияний и, соответственно, времени пребывания в отделении интенсивной терапии новорожденных. Пока недостаточно данных для создания руководства клинической практикой относительно оптимальных схем приема кортикостероидов, требуются дальнейшие исследования, непосредственно сравнивающие дозу, частоту и отдаленные последствия приема кортикостероидов у женщин с риском преждевременных родов, а также исследование других, возможно, оптимальных, дозировок и режимов приема.
Подробнее: https://medvestnik.ru/content/news/Minzdrav-vvodit-massovyi-skrining-na-tri-vida-raka.html
Синдром Ли-Фраумени (LFS) — это редкий, доминантно-наследуемый синдром предрасположенности к раку, который был впервые описан в 1969 году. В большинстве семей он вызван гаметными мутациями в гене TP53 и характеризуется ранней манифестацией множественных специфических видов рака и очень высокой продолжительностью риска развития рака. Несмотря на значительный прогресс в понимании молекулярной биологии гена TP53, оптимальное клиническое лечение этого синдрома еще не подобрано.
Открытие. LFS был впервые описан в 1969 году докторами Фредериком Ли и Джозефом Фраумени-младшим в докладе о семьях с разнообразными ранне-манифестирующими заболеваниями раком, включая детские саркомы и рак молочной железы у молодых людей. LFS имеет аутосомно-доминантный тип наследования с тенденцией к множественным первичным видам рака. Хотя саркомы костей и мягких тканей, рак молочной железы, адренокортикальная карцинома, опухоли головного мозга и лейкемия остаются признаками LFS, последующие исследования показали, что спектр развивающихся форм рака более генетически разнообразен и включает рак легких, прямой кишки, желудка, простаты, яичника, поджелудочной железы, а также лимфомы, меланомы и карциномы сосудистого сплетения. Кроме того, Ли-Фраумени-подобный синдром (LFL — Li-Fraumeni Like) аналогичен LFS, но определяется менее строгими классификационными критериями, следовательно семьи с синдромом LFL имеют более низкую распространенность мутаций TP53; мутация гена TP53 может быть идентифицирована в 70% семейств LFS, в тоже время только в 20–40% семьях с синдромом LFL идентифицируется данная мутация.
Ген ТР53. Ген TP53 был найден в локусе 17p13.1 17-ой хромосомы в 1986 году и впоследствии определен в качестве основной причины LFS. Наиболее вредные гаметные мутации происходят в доменах связывания ДНК, и соматические мутации гена TP53 часто идентифицируются в различных типах рака. Белок р53 играет важную роль в различных клеточных процессах, включая остановку роста, апоптоз или усиленную репарацию ДНК в ответ на повреждение и множественные формы клеточного стресса, а также в регулировании имплантации эмбриона и репродуктивной способности. Кроме того, связь между белком р53, митохондриальным дыханием и регуляцией клеточного цикла может быть вычислена (29e31), поскольку она может дать представление о механизмах, через которые мутации гена ТР53 могут способствовать развитию опухоли. Вариабельность пути белка р53 и относительная редкость LFS сделали поиск различных типов рака и возраста манифестации у пациентов с гаметными мутациями гена TP53 настоящим соревнованием. Однонуклеотидные полиморфизмы (SNP) в генах TP53 и MDM2, интегральный компонент функции белка p53, по-видимому, влияют на возраст манифестации рака в LFS. Короткие теломеры также были связаны с более ранним началом первого случая заболевания раком у индивида. Уровень генетической нестабильности, измеряемый геномной вариацией числа копий (CNV-copy number variations), выше у лиц с гаметными мутациями гена TP53, чем у здоровых пациентов, и повышенный у носителей мутаций с раком в анамнезе. В настоящее время нет никаких инструментов для прогнозирования рака у отдельного человека с LFS: какой тип рака возникнет и в каком возрасте манифестирует. Таким образом, объединяя информацию, полученную из специфической мутации гена TP53, выбранного набора генетических маркеров (например, MDM2 SNP 309; дупликация PIN3 в гене ТР53) и мер генетической нестабильности (например, длина теломера, частота CNV), стало возможным деление людей с LFS на низкие, средние, высокие группы риска, с рекомендациями по скринингу на основе уровня риска.

Классические критерии LFS
■ Пробанд c саркомой, диагностируемой до 45 лет, и ближайший родственник с раком, диагностированным в возрасте 45 лет, и родственник первой или второй степени родства с любым раком с началом в возрасте 45 лет или саркомой в любом возрасте.
Критерий синдрома LFL (Birch)
■ Пробанд с любым детским раком, саркомой, опухолью головного мозга или АКК с манифестацией в возрасте до 45 лет, и родственник первой или второй степени родства с основным видом рака LFS (саркома, рак молочной железы, опухоль головного мозга, АКК или лейкемия) с манифестацией в любом возрасте, и родственник первой или второй степени родства с любым раком с началом до 60 лет.
Критерий синдрома LFL (Eeles)
■ Два человека первой или второй степени родства с основной злокачественной опухолью LFS (саркома, предменопаузальный рак молочной железы, опухоль головного мозга, АКК, лейкемия или бронхоальвеолярный рак легких) в любом возрасте.
Критерий Chompret для генетического анализа гена ТР53
■ Пробанд с однократной опухолью LFS (саркома, предменопаузальный рак молочной железы, опухоль головного мозга, АКК, лейкемия или рак легкого [бронхоальвеолярный]) в возрасте 46 лет, и по крайней мере один родственник первой или второй степени родства с основной опухолью LFS (кроме рака молочной железы, если у пробанда есть рак молочной железы) с манифестацией в возрасте 56 лет или с множественными опухолями
■ ИЛИ пробанд с множественными опухолями (за исключением множественного рака молочной железы), две из которых являются основными опухолями LFS, причем впервые диагностирована в возрасте 46 лет
■ ИЛИ пробанд, диагностированный с карциномой АКК или сосудистого сплетения, независимо от семейной истории.

■ УЗИ брюшной полости каждые 3–4 месяца от рождения до 10 лет
Рак молочной железы
■ Тренировка и обучение в самообследовании груди с 18 лет
■ Клиническое исследование груди каждые 6–12 месяцев, начиная с 20–25 лет
■ Ежегодная МРТ молочной железы, начиная с 20–25 лет до 50 лет
■ Обсуждение двусторонней мастэктомии, уменьшающей риск
Опухоль мозга
■ МРТ мозга, которая должна быть включена в ежегодный МРТ-анализ всего тела
■ Ежегодная неврологическая экспертиза
■ Ежегодная МРТ всего тела
■ Ежегодный комплексный медицинский осмотр
Гематопоэтический рак
■ Ежегодный полный анализ крови с 18-летнего возраста
■ Колоноскопии 5 раз в год, увеличение на 2–5 раз в год от 25 лет или, в случаях известной семейной историей этого заболевания, с возраста предшествующего самой ранней манифестации минус 10 лет
■ Необходимо дать полную информацию о риске, связанном с колоноскопией
Рак желудка
■ Эндоскопия 5 раз в год с полным объяснением риска эндоскопии, увеличение
на 2–5 раз в год от 25 лет или, в случаях с известной семейной историей
этого заболевания
Клинический случай.
Пациент Б., 19 лет (1991 г. р.), впервые был госпитализирован в ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН в ноябре 2006 г. в 15-летнем возрасте с диагнозом остеосаркома нижней трети левой бедренной кости. Диагноз верифицирован путем открытой биопсии. Проведено комбинированное лечение, которое на первом этапе включало 4 курса неоадъювантной полихимиотерапии по схеме: доксорубицин + цисплатин (с 30.11.06 по 17.02.07), на втором — хирургическое пособие в объеме резекции дистального отдела левой бедренной кости с замещением дефекта эндопротезом коленного сустава (13.03.07). При гистологическом исследовании удаленной опухоли отмечены признаки лечебного патоморфоза III степени, в краях резекции элементов опухоли не найдено.
В адъювантном режиме с 27.03.07 больной получил с чередованием 3 курса полихимиотерапии по схеме: доксорубицин + циклофосфан + цисплатин и 3 курса по схеме: ифосфамид с эквивалентным количеством уромитексана + этопозид. При очередном контрольном обследовании в апреле 2009 г. выявлено объемное образование в правом надпочечнике, первично расцененное как метастаз остеосаркомы. В связи с этим больному было проведено 3 курса полихимиотерапии по схеме: ифосфамид + этопозид + карбоплатин (с 06.09 по 08.09), на фоне которой появились признаки хронической почечной недостаточности. На следующем этапе выполнена лапароскопическая адреналэктомия справа. По результатам планового гистологического исследования диагностирован адренокортикальный рак. В марте 2010 г. у пациента появились жалобы на головную боль, тошноту, рвоту и шаткость при ходьбе. При МРТ головного мозга с контрастированием визуализировано объемное образование округлой формы с нечеткими контурами, размерами 3,0 × 2,9 см, кистозно-солидной структуры в области червя мозжечка с вентральным распространением в IV желудочек, на фоне окклюзионной гидроцефалии, вновь предварительно расцененный как метастаз остеосаркомы. 31.03.10 больному выполнено хирургическое вмешательство в объеме удаления опухоли червя мозжечка с наружным вентрикулярным дренированием переднего рога бокового желудочка. При плановом морфологическом исследовании операционного материала констатировано разрастание медуллобластомы GIV преимущественно «классического» варианта строения. На следующем этапе (05.05.10—10.06.10) проведена лучевая терапия на головной и спинной мозг (СОД 34 Гр + локально на область задней черепной ямки разовая очаговая доза 2 Гр, СОД 54 Гр). Химиотерапия больному не проводилась ввиду наличия почечной недостаточности. При контрольном комплексном обследовании в октябре 2010 г. данных, подтверждающих прогрессирование заболевания, не получено. Ухудшение состояния пациента произошло в январе 2011 г., когда появились грубый нижний парапарез и нарушение функции тазовых органов. При МРТ головного и спинного мозга с контрастированием обнаружено метастатическое поражение продолговатого мозга, спинного мозга, мозговых оболочек. Пациент умер 27.02.11 от прогрессирования основного заболевания.
Семейный анамнез пациента, за исключением деда по отцовской линии, умершего от рака желудка в возрасте 70 лет, не отягощен. С учетом «классического» варианта развития ПМЗН, характерных для СЛФ, пациенту было проведено молекулярно-генетическое обследование в объеме определения первичной структуры кодирующей части гена ТР53 (3–11-й экзон) для исключения/подтверждения наследственной этиологии заболевания с использованием методов полимеразной цепной реакции, конформационно-чувствительного электрофореза и секвенирования.
При исследовании ДНК, выделенной из лимфоцитов периферической крови, выявлены наследуемые герминальная миссенс-мутация G245S (p.Gly245Ser; c.733G/A) в 7-м экзоне гена ТР53 в гетерозиготном состоянии и полиморфные варианты в 4-м экзоне — R72P и 3-м интроне — Int3dup16 в гетерозиготном состоянии. Выявленные структурные перестройки зарегистрированы в международной базе данных IARC. Для молекулярно-генетического анализа опухоли были доступны только образцы операционного материала медуллобластомы. При исследовании ДНК, выделенной из срезов с парафиновых блоков опухоли с использованием метода прямого секвенирования, выявлен аллельный дисбаланс (потеря гетерозиготности) в 7-м локусе экзона гена ТР53 с потерей аллеля «дикого» типа, что приводит к полной инактивации функций гена ТР53, подтверждая развитие опухоли по классическому механизму наследственного канцерогенеза.
Все три локализации рекомендованы ВОЗ и являются общепринятыми в мире для скрининговых программ. Остальные считаются район- или страноспецифическими», - пояснил он выбор нозологий.
Андрей Каприн отметил, что опубликованные Минздравом рекомендации по проведению трех скринингов полностью совпадают с рекомендациями ВОЗ: «Колоректальный рак – это анализ кала на скрытую кровь, и не просто анализ, а иммунохимический, с высокочувствительным разрешением. Маммологические исследования на маммографе - с двумя мнениями, это тоже международный стандарт. Рак шейки матки – цитологическая биопсия».
Важной задачей онколог считает осуществление контроля за качеством выполнения обследования: «Любой скрининг можно низвести на месте до абсурда. Поэтому нужно, чтобы выполнялся стандартизированный протокол, и тут нельзя снимать ответственность с главных онкологов в регионах, важно, чтобы они отслеживали применяемые методики».
Касаясь рака других локализаций, Андрей Каприн сказал, что в каждом регионе может предлагаться регионспецифический скрининг, то есть учитывающий особенности каждого субъекта РФ.
«Скрининг в стране должен проводиться, не вредя ни экономической, ни социальный ситуации, - обобщил он далее. - Есть огульные предложения проводить скрининги. Но надо понимать, выгодны ли они стране, решит ли скрининг ту задачу, которая на него возложена. Потому что есть редкие опухоли. Многие горячие головы предлагают идеи для скрининга, но они не рекомендованы ВОЗ. При тех затратах, которые мы будем нести, они не оправдают себя по основным онкологическим показателям: одногодичная летальность, выявляемость на ранних стадиях, увеличение пула наблюдаемых пациентов. Все эти вещи тоже нужно учитывать».
Подробнее: https://medvestnik.ru/content/news/Minzdrav-vvodit-massovyi-skrining-na-tri-vida-raka.html
Лечение сахарного диабета 2-го типа должно начинаться с оценки состояния сердечно-сосудистых заболеваний (ССЗ), других сопутствующих заболеваний и предпочтений пациента. Об этом говорится в совместном консенсусном заявлении Американской диабетической ассоциации (ADA) и Европейской ассоциации по изучению сахарного диабета (EASD) 2018 года.
Предварительная версия документа была представлена на 78-й научной сессии ADA 26 июня 2018 года в Орландо, штат Флорида. Финальная версия проекта, призванная обновить актуальное руководство ADA/EASD 2015 года по управлению гипергликемией при диабете 2-го типа, будет представлена в октябре 2018 года на ежегодной встрече EASD в Берлине и опубликована в журналах Diabetes Care и Diabetologia.
В целом в документе ADA/EASD рекомендована оценка сердечно-сосудистого статуса в качестве первого шага в определении подхода к лечению диабета 2-го типа. Отдельные алгоритмы лечения адресованы пациентам с атеросклеротическими сердечно-сосудистыми заболеваниями и с сердечной недостаточностью. Модификация образа жизни и применение метформина по-прежнему считаются основой лечения.
В качестве обновленной рекомендации с 2015 года «мы рекомендуем, чтобы сопутствующие патологии были рассмотрены в первую очередь, потому что они влияют на выбор конкретного лекарства, снижающего уровень глюкозы. Наличие ССЗ является веским показателем для выбора некоторых препаратов, снижающих уровень глюкозы», – отметили авторы работы.
Подробнее: https://medvestnik.ru/content/news/Predstavlen-proekt-obnovlennyh-rekomendacii-po-lecheniu-saharnogo-diabeta.html
«Предлагаем за заведомо ложный вызов пожарной охраны, полиции, скорой медицинской помощи или иных специализированных служб установить штраф в размере от 1 500 до 3 тысяч рублей или обязательные работы на срок до ста часов. За повторный ложный вызов предлагается установить повышенную ответственность в виде штрафа в размере от 4 до 5 тысяч рублей или обязательных работ на срок до двухсот часов», – пишут в пояснительной записке.
В качестве аргумента за ужесточение наказания авторы приводят статистику работы службы «112», согласно которой ежедневно операторы системы в Московской области принимают свыше 22 тысяч звонков, около 4% из которых – ложные.
«Если за заведомо ложное сообщение об акте терроризма Уголовным кодексом Российской Федерации предусмотрены серьезные санкции, то административный штраф, установленный Кодексом Российской Федерации об административных правонарушениях за заведомо ложный вызов специализированных служб, составляет от 1 000 до 1 500 рублей. При этом в ходе реагирования на ложные вызовы затрачиваются значительные материальные ресурсы. Объем затрат зависит от серьезности сообщения», – объясняют авторы законопроекта.
В мае 2015 года 19-летняя жительница Ярославля испытала сильный приступ астмы. Находившаяся рядом с ней 11-летняя сестра решила позвонить в скорую помощь, но в диспетчерской экстренной службы усомнились в сообщении девочки и перенаправили звонок в полицию как ложный вызов.
Подробнее: https://vademec.ru/news/2018/06/26/v-gosdumu-vnesli-proekt-ob-uzhestochenii-nakazaniya-za-lozhnyy-vyzov-skoroy/
Российское кардиологическое общество (РКО) провело мониторинг рынка труда в здравоохранении, опросив работодателей из разных регионов. Оказалось, что респонденты не только поддерживают укрупнение медицинских специальностей (например, объединение пластической хирургии с хирургией), но и выступают за расширение полномочий среднего медперсонала.
Исследование проводилось за счет Фонда президентских грантов по поручению НМП и при поддержке Минздрава. Оно стало частью проекта «Обеспечение гарантий уровня и качества квалификации медицинских работников при оказании медицинской помощи посредством отраслевой рамки квалификаций в здравоохранении».
В опросе приняли участие работодатели, заполнившие 465 анкет, посвященных специалистам с высшим медицинским образованием, и 378 анкет о среднем медицинском персонале. Активнее прочих в исследовании приняли участие респонденты из Москвы, Санкт-Петербурга, Воронежской, Волгоградской, Свердловской областей и Алтайского края.
Дефицит врачей отдельных специальностей отметили 40% респондентов. Причина, по их мнению, – «экономические и социальные аспекты». Среднего медперсонала большинству участников опроса – 64,8% – оказалось достаточно.
Готовность выпускников высших учебных заведений к самостоятельной работе респонденты РКО оценили как низкую из-за недостаточной практики во время обучения. В 41% ответов говорится о достаточной подготовке среднего медперсонала, лишь 7% анкетируемых указывают на слабую подготовку выпускников в колледжах.
Около 30% респондентов поддержали объединение ряда специальностей. Кардиологию, гастроэнтерологию, пульмонологию, ревматологию, гематологию, клиническую фармакологию, по их мнению, можно объединить с терапией. Бактериологию, вирусологию, паразитологию, санитарно-гигиенические исследования, лабораторную генетику – с клинической лабораторной диагностикой. Детскую эндокринологию следует слить с эндокринологией, пластическую хирургию – с хирургией, косметологию – с дерматологией, стоматологию хирургическую, детскую, ортопедическую с общей стоматологией и так далее.
В случае со средним медперсоналом работодатели указали возможность «значительного расширения полномочий» в организации сестринского дела, педиатрии, анестезиологии и реаниматологии, общей практике, реабилитации, что в целом соответствует общемировым тенденциям в области сестринского дела. Сами медсестры, как установил Vademecum, тоже не против большей клинической самостоятельности – вести сестринский прием, а также ставить так называемый сестринский диагноз и назначать лекарства.
Большинство респондентов РКО предлагают отнести квалификацию «фельдшер» к шестому уровню квалификации, «основываясь на сложности выполняемых трудовых функций, полномочиях, ответственности и характере знаний». В РКО предлагают вообще перевести фельдшеров из перечня специалистов среднего звена в перечень специальностей высшего образования (бакалавриат). На шестом уровне квалификации для фельдшеров настаивает и профессиональное сообщество в лице Ассоциации медицинских сестер России.
Подробнее: https://vademec.ru/news/2018/06/29/tret-rabotodateley-podderzhali-ukrupnenie-meditsinskikh-spetsialnostey/