Новости
В настоящее время существует мало фармакологических методов лечения наркомании, а те, что есть, имеют низкую эффективность у многих людей. Это может быть связано с постоянными функциональными изменениями в головном мозге, индуцированными приемом наркотиков и лекарств, индивидуальным фенотипом зависимости. Постоянный прием наркотиков, связанный с зависимостью, вызывает изменения в структуре и функции клеток и путей головного мозга, которые лежат в основе аддиктивного поведения, например, поиск наркотиков и склонность к рецидивам. Поэтому определение целевых механизмов, которые управляют функциональными изменениями работы мозга, это важный шаг в изучении этиологии зависимости и разработки новых методов лечения. Это потребует всестороннего понимания нейробиологических процессов зависимости, включая роль экспрессии генов и регуляцию экспрессии, изменения в структуре и функции нейронов, индуцированные приемом наркотиков [1].
Термин «эпигенетика» используется для описания динамических молекулярных модификаций, отражающихся на хроматине в ядре клетки, что регулирует функции таких процессов, как репарация ДНК, организация хроматина, транскрипция и сплайсинг РНК и другие. Ученые, исследующие явление наркомании, заинтересовались изучением эпигенетики из-за того факта, что индивидуальный опыт, в частности волевое, многократное употребление наркотиков, изменяет конфигурацию хроматина в мозге, что вариативно в зависимости от области мозга и типа клетки [2, 6].
Эпигенетические механизмы действуют на протяжении всей жизни. Такие механизмы, вероятно, важны на ранних этапах развития, так как вносят свой вклад в различия между индивидуумами, которые возникают случайно даже при одинаковых условиях среды. Когда определенные типы эпигенетических модификаций после их возникновения являются постоянными, возможно, что определенные эпигенетические изменения, возникающие в результате поведенческого опыта или случайных событий развития, лежат в основе постоянных изменений в функции мозга [3].
Нейроэпигенетический ландшафт
Считается, что путем регулирования процессов, связанных с ДНК, эпигенетические изменения, индуцированные веществами, способствуют нарушению клеточных функций, чем и объясняется патогенез наркомании. Есть многообещающий терапевтический потенциал в отношении нацеливания на ключевые эпигенетические модификации для борьбы с привыканием [2].
Посттрансляционные модификации (ПТМ) гистонов меняют пространственную структуру хроматина, контролируя процессы, связанные с ДНК. Гистоновые субъединицы могут быть модифицированы путем ацетилирования, метилирования, фосфорилирования, рибозилирования АДФ, убиквитилирования и сумоилирования и др. Гистоновые ПТМ обратимы: они динамически осуществляются записывающими белками, которые распознаются считывающими белками, которые опосредуют клеточный ответ, и удаляются стирающими белками. Экспрессия и функция многочисленных записывающих белков, стирающих и считывающих изменяются как у людей с зависимостью, так и в животных моделях зависимости. Восстановление нормальной функции этих белков с помощью фармакотерапии — новая ниша для разработки лекарств против наркомании [2].
.
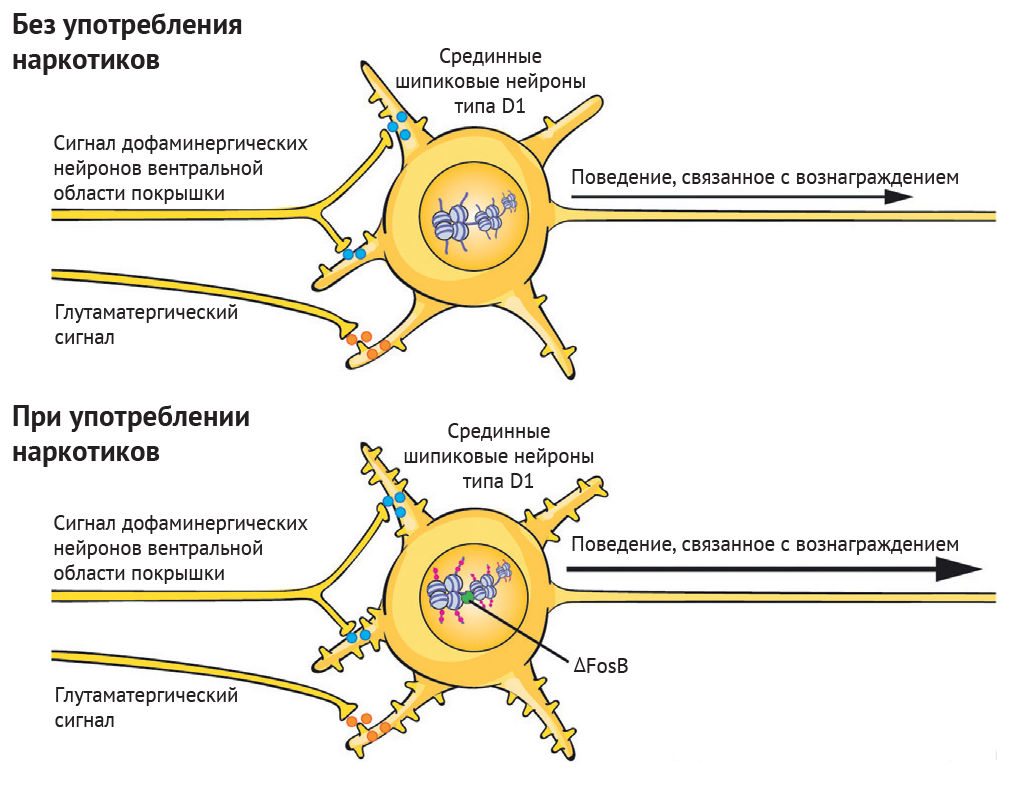
Внизу: хроническое употребление наркотиков нарушает баланс регулирующих белков, записывающих и стирающих, что приводит к эпигенетическим адаптациям в определенных локусах в ядре срединных шипиковых нейронов.
Адаптации и лекарственная индукция факторов транскрипции (например, DFosB) опосредуют изменения транскрипции многих генов, включая гены, кодирующие нейротрансмиттерные рецепторы, белки цитоскелета и ионные каналы. Вследствие этих транскрипционных адаптаций меняется морфология срединных шипиковых нейронов (например, показана повышенная плотность дендритных шипиков) и физиологическая функция в отношении процессов вознаграждения. Это лежит в основе поведенческих дезадаптаций, определяющих зависимость.
Синаптическая пластичность в контексте наркозависимости
Синаптическая пластичность — это возможность изменения силы синапса (величины изменения трансмембранного потенциала) в ответ на активацию постсинаптических рецепторов [4].
Начальная доза наркотического препарата потенцирует возбуждающие афферентные волокна на дофаминовые нейроны вентральной области покрышки. Потенцирование возбуждающих глутаматергических афферентов из медиальной префронтальной коры и вентрального гиппокампа на срединные шипиковые нейроны прилежащего ядра, экспрессирующие рецептор D1, ассоциировано с поиском наркотиков. Для индукции такой пластичности обычно требуется дофамин, механизмы экспрессии варьируются, и метаботропные рецепторы глутамата могут ограничивать потенцирование. Для возбуждающей передачи характерной особенностью является инсерция глутаматных рецепторов AMPA — и в некоторых случаях инсерция проницаемых для кальция AMPA-рецепторов без GluA2 в постсинаптическую плазматическую мембрану. Вызванная лекарственным средством пластичность передачи ГАМК выражается пресинаптическим механизмом, изменяющим высвобождение ГАМК. Нейроны прилежащего ядра также экспрессируют проницаемые для кальция AMPA-рецепторы после воздействия лекарственного средства, особенно при употреблении кокаина [3,5].
.
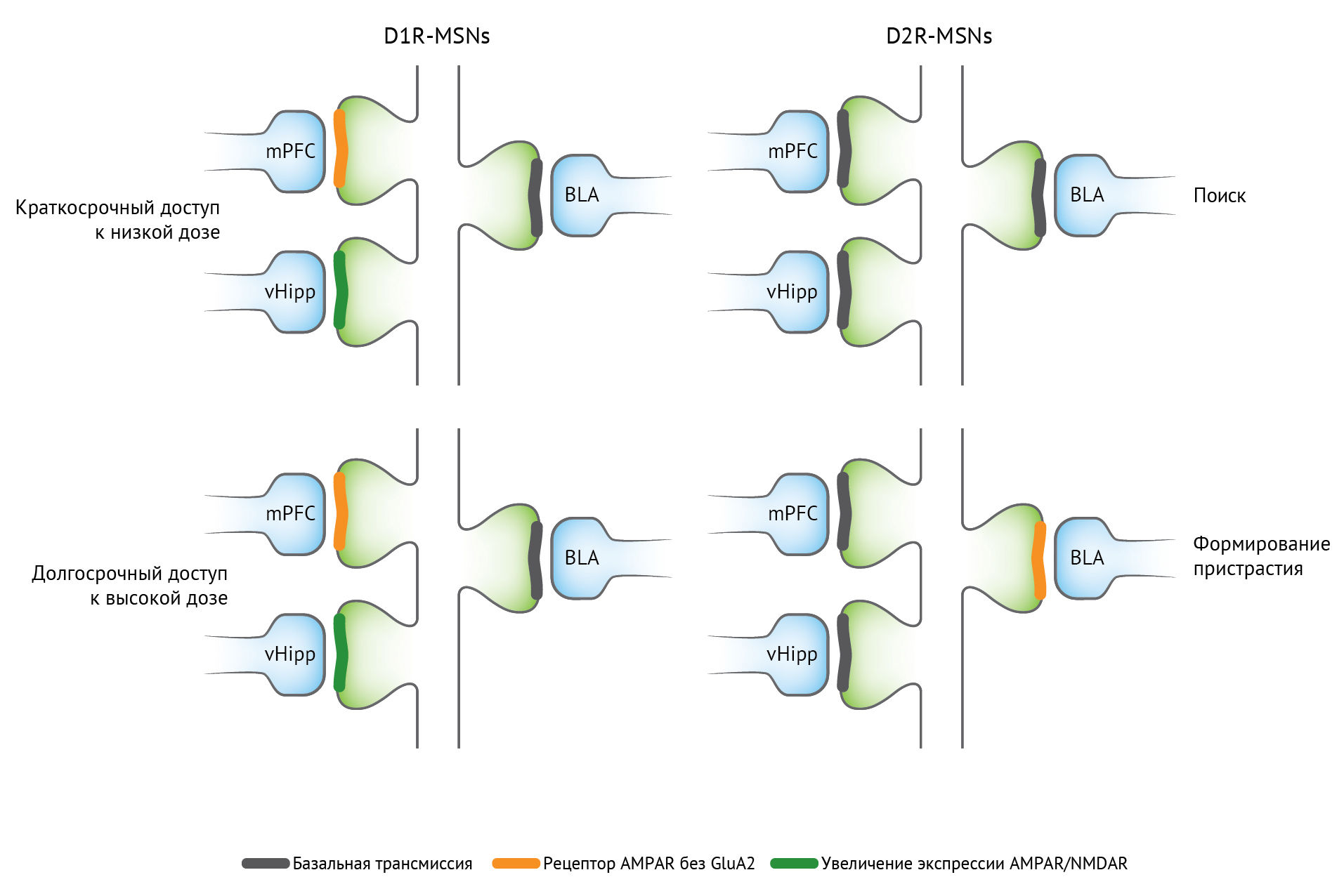
Сокращения: AMPAR — рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты; БЛА — базолатеральная миндалина; D1R — дофаминовый рецептор — D1 рецептор; D2R — дофаминовый рецептор D2; mPFC — медиальная префронтальная кора; MSN — срединный шипиковый нейрон; NMDAR — N-метил-D-аспартатный рецептор; vHipp — вентральный гиппокамп.
Воздействие кокаина и опиатов регулирует общее количество функциональных глутаматергических синапсов на прилежащем ядре срединных шипиковых нейронов, так как молчащие синапсы экспрессируют NMDA-рецептор и не экспрессируют AMPA-рецептор [3].
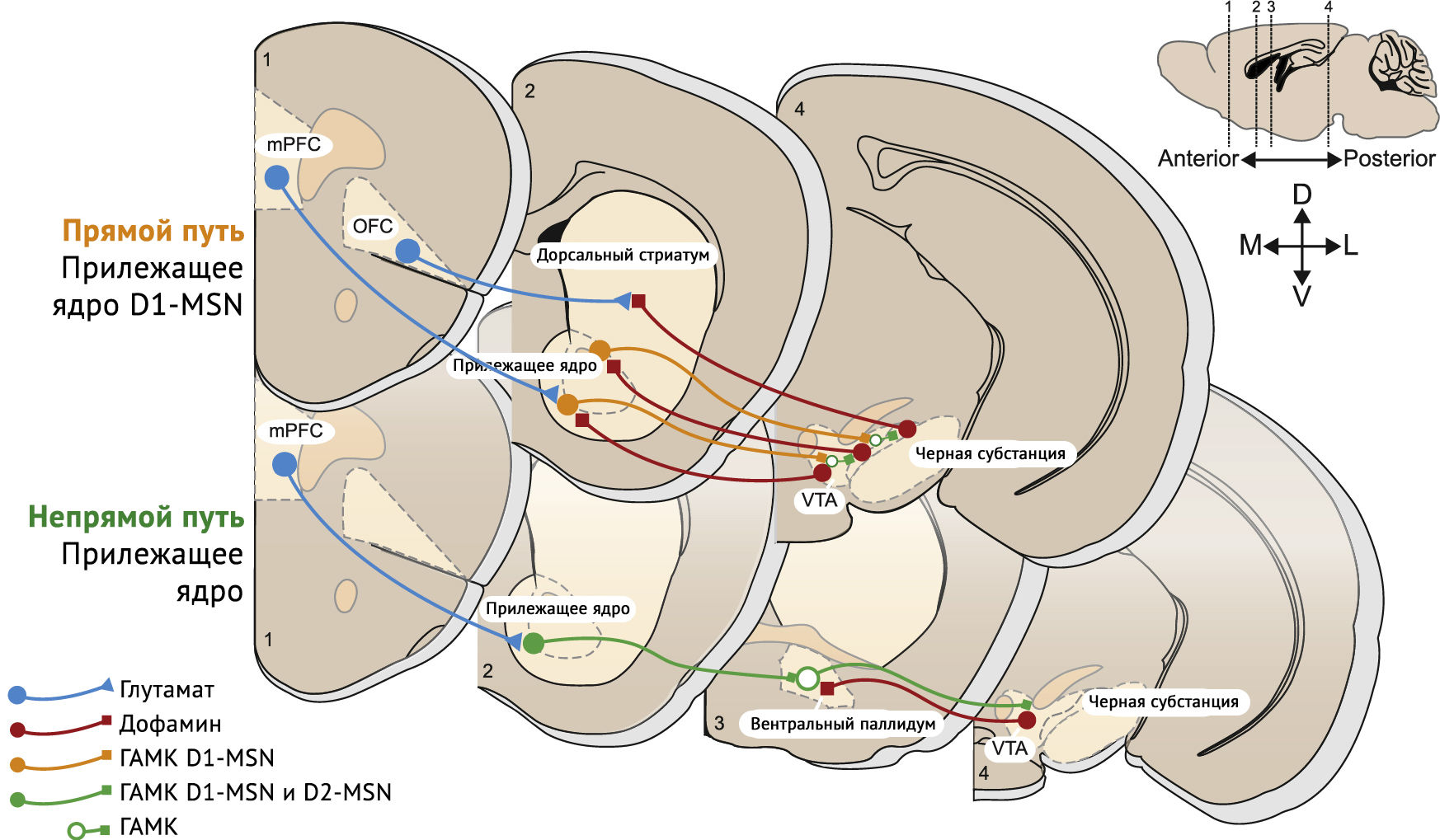
АМРА-рецептор (рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты, AMPAR), релокализованные после первого воздействия наркотических средств, заменяются на GluA2-содержащие рецепторы, которые синтезируются de novo. В прилежащем ядре сопутствующая активация рецепторов D1R и N-метил-D-аспартата (NMDAR) запускает путь MAP-киназы-ERK, который влияет на транскрипцию. Ремоделирование путей прилежащего ядра, лежащее в основе привычек и зависимостей, и нескольких областей выше, иннервирующих прилежащее ядро через глутаматергические нейроны — префронтальная кора, вентральный гиппокамп, базолатеральная миндалина и таламус, каждый из которых получает дофамин из дофаминовых нейронов вентральной области покрышки — появляются в качестве основных локусов ремоделирования путей дофамина. Область, которой уделяется наибольшее внимание — медиальная префронтальная кора, с нисходящими глутаматергическими путями от медиальной префронтальной коры до прилежащего ядра и нескольких других подкорковых областей, связанных с неадаптивным поведением и индивидуальной уязвимостью (рисунок 3) [3].
.
Синаптическое потенцирование наблюдалось в афферентных волокнах проекционных срединных шипиковых нейронов D1 и D2 и опосредовано постсинаптическим механизмом экспрессии. Механизмы индукции этих синаптических изменений недостаточно изучены. При хроническом воздействии наркотиков может быть задействовано все больше и больше нервных узлов и путей. Фактически анатомические знания и эксперименты подтверждают эту концепцию [3].
Стимуляция более дорсальной предлимбической области способствует употреблению наркотиков, тогда как стимуляция более вентральной инфралимбической области сдерживает рецидив после вымирания. Обе области могут вести и сдерживать поиск наркотиков в зависимости от текущей ситуации и исходных данных пациента. Усовершенствованная модель учитывает проекции путей отдельных нейронов медиальной префронтальной коры/прилежащего ядра, которые объединяются в прелимбической области и инфралимбической, чтобы достичь ядра и оболочки прилежащего ядра. При повторении приема нракотиков активность инфралимбической превалирует над активностью прелимбической области, а инактивация инфралимбической области восстанавливает целенаправленное поведение. Эта модель предполагает, что привычные показатели достигнуты при переключении с прелимбической области на инфралимбическую. Были вовлечены и другие области префронтальной коры — дисфункция орбитофронтальной коры, которая может способствовать неконтролируемому потреблению наркотических веществ. Если медиальная префронтальная кора и орбитофронтальная кора играют роль в обновлении аффективной ценности стимулов и результата действия во время целенаправленного поведения, они могут дисфункции в патологических состояниях, где зависимость является ключевым симптомом [3].
Развитие наркозависимости начинается с первого приема и постепенно консолидируется во время повторного, но все еще контролируемого употребления наркотиков. По мере того как потребление растет, прием наркотиков становится необходимым, что приводит к потере контроля над употреблением наркотиков. Это развитие может зависеть от формирования привычки, которое постепенно становится все более и более выраженным, что в конечном итоге квалифицируется как зависимость [3].
Гипертрофическая кардиомиопатия (ГКМП) - наследственное заболевание с выраженной анатомической, клинической и генетической гетерогенностью. Различен и ее прогноз: есть формы с неизмененной продолжительностью жизни, без серьезных осложнений, а есть варианты, требующие хирургического лечения в раннем возрасте. Поиск причин этой гетерогенности - цель настоящего исследования.
Материал и методы. Инструментальное обследование больных с ГКМП включало электрокардиографию, эхокардиографию, мультиспиральную компьютерную томографию и магнитно- резонансную томографию с гадолинием. У всех пациентов выполнены поиск мутаций в 10 генах, кодирующих саркомерные белки миокарда, определение лейденовской мутации p.R506Q в гене F5.
Результаты. Прооперированы 120 пациентов с ГКМП - им устраняли внутрисердечные аномалии. На основании результатов инструментального обследования предложена структурно-анатомическая классификация ГКМП. Ранняя манифестация и ранние показания к операции (до 30 лет) были выявлены у 21 (17,5%) пациентов. У 17 из 21 пациентов (81%) фенотип соответствовал диффузно-генерализованному фенотипу с субмитральной обструкцией: гипертрофия всей перегородки и множественность гипертрофированных папиллярных мышц, смещенных в зону верхушки левого желудочка. У 25% выявлены двухуровневые градиенты давления. Генетическая причина заболевания выявлена у 10 пациентов, из них 3 имели >1 генетического фактора риска. Все пациенты успешно перенесли хирургическое вмешательство, причем у 6 из них операция выполнена двойным чрезаортальным и чрезмитральным доступом. Высокий риск внезапной сердечной смерти отмечен у 1/3 пациентов (7 человек), что потребовало имплантации кардиовертера-дефибриллятора.
Заключение. Предложена классификация анатомических и гемодинамических вариантов ГКМП. Ранняя манифестация ГКМП (до 30 лет) чаще всего ассоциирована с диффузно-генерализованным фенотипом, характеризуется быстрым прогрессированием и серьезным прогнозом.
Ключевые слова:гипертрофическая кардиомиопатия, расширенная миоэктомия, внезапная сердечная смерть, MYH7, MyBPC3, ДНК-диагностика
Для цитирования: Дземешкевич С.Л., Мотрева А.П., Калмыкова О.В., Мартьянова Ю.Б., Синицын В.Е., Мершина Е.А., Николаева Е.В., Раджабова Г.М., Поляк М.Е., Никитюк Т.Г., Домбровская А.В., Фролова Ю.В., Соловьева С.Е., Нечепуренко А.А., Заклязьминская Е.В. Гипертрофическая кардиомиопатия у молодых: фенотип, генотип и варианты лечебной тактики // Клин. и эксперимент. хир. Журн. им. акад. Б.В. Петровского. 2019. Т. 7, No 3. С. 54-62. doi: 10.24411/2308- 1198-2019-13006
Статья поступила в редакцию 19.06.2019. Принята в печать 25.07.2019.
Гипертрофическая кардиомиопатия (ГКМП) - это аутосомно-доминантное заболевание, которое наиболее часто диагностируется среди всех генетических пороков сердца и повсеместно встречается с частотой 1:200 [1]. Наиболее часто оно развивается в результате мутаций в генах, кодирующих саркомерные белки миокарда [1]. Одна- ко за этим диагнозом часто скрываются не только значимо различающиеся фенотипы заболевания с различным генетическим вкладом, но и несаркомерные синдромальные формы гипертрофии левого желудочка (ЛЖ) [1, 2].
Высокая частота заболевания свидетельствует о том, что запрос на специализированную (экспертного уровня) помощь при ГКМП резко увеличится уже в ближайшие годы. Однако большой сложностью является отсутствие единой лечебной тактики у этой группы пациентов, разнородной по генетическим причинам, клиническим проявлениям и прогнозу заболевания.
В настоящей работе мы приводим нашу анатомическую классификацию ГКМП с детальной характеристикой особой фенотипической формы, которую можно обозначить как диффузно-генерализованную (субмитральную) ГКМП.
Характеристика выборки
К настоящему времени нашим коллективом было выполнено диагностическое обследование и хирургическое лечение ГКМП в условиях искусственного кровообращения у 120 пациентов. В настоящей работе приведен анализ подгруппы молодых пациентов, у которых клинически значимые симптомы кардиомиопатии (КМП), поставившие вопрос о необходимости хирургического лечения, развились до 30 лет. Основные жалобы на момент обращения за хирургическим лечением были типичны и отчетливо выражены: сердцебиения, кардиалгии, головокружения, одышка, снижение переносимости нагрузок, синкопе, подъемы артериального давления. В эту группу вошел 21 пациент (17,5% прооперированных), из них 14 мужчин (соотношение М:Ж внутри подгруппы - 2:1). В 8 случаях отчетливо прослеживался семейный анамнез заболевания. Сроки клинической манифестации и постановки диагноза варьировали от первого года жизни до 30 лет, распределившись поровну на каждое десятилетие жизни: от рождения до 10 лет - у 7 больных, от 10 до 20 лет - у 7 больных, и от 20 до 30 лет - также у 7 больных. Средний возраст манифестации заболевания составил 17±11 лет, средний возраст хирургического вмешательства в этой группе - 25±8 лет (минимальный возраст - 14 лет, максимальный - 34 года).
Результаты инструментальной диагностики
На основании результатов инструментального обследования [трансторакальная эхокардиография (ЭхоКГ), мультиспиральная компьютерная то- мография (МСКТ) и магнитно-резонансная томография (МРТ) сердца с гадолинием] 120 пациентов, которым была выполнена расширенная миоэктомия, были выделены 3 структурно-функциональных варианта ГКМП (рис. 1, табл. 1). У молодых пациентов чаще всего выявлялся субмитральный диффузно-генерализованный вариант ГКМП - 81% наблюдений (17 пациентов из 21). У оставшихся 4 пациентов из этой подгруппы выявлен базальный септальный тип ГКМП.
Рис. 1. Основные фенотипы гипертрофической кардиомиопатии, выделенные по зонам структурной дезорганизации миокарда: базальная септальная (субаортальная) - слева; диффузная генерализованная (субмитральная) - в центре; дистальная (верхушечная) - справа
Fig. 1. The main phenotypes of hypertrophic cardiomyopathy defined by structural desorganization areas: basal septal (subaoptic) - left; diffuse generalized (submitral) - middle; distal (apical) - right
В подгруппе молодых больных толщина межжелудочковой перегородки (МЖП) варьировала от 19 до 55 мм; перепад (градиент) давления в выходном отделе левого желудочка (ВО ЛЖ) на уровне митрально-перегородочного контакта в покое составлял 42-143 мм рт.ст. отчетливый второй перепад давления в средней трети ЛЖ был зарегистрирован у 5 (25%) пациентов и составил 31-80 мм рт.ст. У одного пациента 14 лет был выявлен трехуровневый перепад давления из-за наличия фиброзной субаортальной мембраны непосредственно под аортальным клапаном с перепадом давления 32 мм рт.ст. Еще у одного пациента выявлен двухстворчатый аортальный клапан с признаками перенесенного инфекционного эндокардита и перепадом давления на клапане 98 мм рт.ст. (при этом перепад давления в ВО ЛЖ не превышал 60 мм рт.ст.). Число папиллярных мышц было увеличено (от 5 до 8 мышц) у всех 17 пациентов с диффузно-генерализованным фенотипом ГКМП, что во всех случаях сопровождалось смещением оснований папиллярных мышц к верхушке ЛЖ.
Переднее систолическое движение митрального клапана с формированием митральной недостаточности (МН) II-III степени выявлено в 100% наблюдений и практически у всех отмечено увеличение длины передней створки митрального клапана (МК).
Интрамиокардиальный фиброз различной степени выраженности был выявлен преимущественно в зонах максимальной гипертрофии (на протяжении всей перегородки), в том числе в гипертрофированных папиллярных мышцах. Некомпактный миокард в зоне верхушки и боковой стенки ЛЖ выявлен у одной пациентки (оперирована в возрасте 32 лет).
Фракция выброса ЛЖ была значительно увеличена у 18 пациентов (68-80%), часто с практически полной облитерацией ЛЖ в систолу. У 3 пациентов было выявлено снижение фракции выброса с увеличением полости ЛЖ по типу песочных часов и истончением миокарда в зоне верхушки ЛЖ (рис. 2). У этих пациентов отмечено и самое значительное увеличение размеров левого предсердия (до 7,5 см), и выраженный интрамиокардиальный фиброз.
Результаты хирургического лечения
Всем пациентам выполнено открытое оперативное вмешательство в условиях искусственного кровообращения. Имплантация кардиовертера-дефибриллятора в связи с 5-летним риском внезапной сердечной смерти (ВСС) >6%, рассчитанным по общепринятым критериям [2] до или после основной операции, выполнена 7 (33%) пациентам.
Все открытые расширенные миоэктомии были выполнены трансаортальным доступом. Дополнительно 6 пациентам проведено хордосохраняющее протезирование МК механическим протезом с одновременным удалением избытка папиллярных мышц, париетальной резекцией сохраненных мышц и резекцией избыточной трабекулярности в области верхушки ЛЖ (рис. 3).
Рис. 3. Увеличение объема полости левого желудочка у пациентов с диффузно- генерализованной симметричной формой гипертрофической кардиомиопатией (объяснения в тексте)
Fig. 3. Operation of the left ventricular volume restoration in patients with diffuse generalized HCM form (commentary is in the text)
Дополнительно одному пациенту выполнена резекция субаортальной мембраны, еще одному - протезирование аортального клапана. Практически всем пациентам была необходима дополнительная тщательная ревизия межпапиллярного пространства с рассечением и иссечением аномальных диагональных хорд и мышечных пучков, соединяющих переднюю и заднюю группу папиллярных мышц с перегород- кой, боковой и нижней стенкой ЛЖ. Иссеченные при протезировании створки МК подвергали гистологическому исследованию, равно как и образцы МЖП, верхушки ЛЖ и папиллярных мышц миокарда (рис. 4).
Рис. 4. Морфологическая картина, характерная для гипертрофической кардиомиопатии
Fig. 4. Histopathological findings specific for the hypertrophic cardiomyopathy
Все пациенты успешно перенесли хирургическое вмешательство и были выписаны из стационара в удовлетворительном состоянии. Осложнений, связанных с расширенным объемом хирургического вмешательства (полная поперечная блокада, дефект МЖП или аортальная недостаточность), не наблюдалось.
Ближайшие и средние отдаленные результаты хирургического лечения такой субмитральной формы ГКМП в этой подгруппе молодых пациентов вполне удовлетворительные. Наблюдается стойкое улучшение самочувствия, устранение симптомов сердечной недостаточности. Однако было 2 летальных случая в течение первых 3 лет после операции, оба связаны с генетическими особенностями оперированных пациентов. Один пациент (М, 17 лет, диффузно-генерализованная форма) с подтвержденным синдромом LEOPARD умер от "электрического шторма" на фоне серии неэффективных срабатываний кардиовертера-дефибриллятора. В руководстве ESC2014 по диагностике и лечению ГКМП [2] прямо указывается, что пациенты с несаркомерными подтвержденными синдромальными формами должны рассматриваться как пациенты особо высокого риска ВСС. Однако, к сожалению, даже сочетание имплантации кардиовертера-дефибриллятора и антиаритмической терапии в настоящее время не имеет 100% эффективности. Второй пациент (М, 25 лет, диффузно-генерализованная форма) с дилатационной фазой ГКМП и генетически подтвержденной тромбофилией (носитель лейденовской мутации), умер в результате тромбоза механического протеза.
Результаты ДНК-диагностики
Результаты ДНК-диагностики были полу- чены для 18 из 21 пациентов, для 3 пациентов исследование выполняется в настоящее время. Методом полупроводникового секвенирования на платформе IonTorrent выполнено таргетное секвенирование кодирующей последовательно- сти 10 генов, мутации в которых наиболее часто приводят к ГКМП: MYH7, MYBPC3, TNNT2, TPM1, MYL2, MYL3, TNNI3, LDB3, ACTC1, TAZ. При клинически обоснованном подозрении на моногенные синдромальные формы выполняли прямое секвенирование таргетных генов. Патогенные и вероятно патогенные мутации в генах, кодирующих саркомерные белки миокарда, выявлены у половины обследованных пациентов (9 человек) (табл. 2). У одного пациента (DCM42, M, 16 лет) верифицирована несаркомерная форма гипертрофии миокарда (синдром LEOPARD). Таким образом, достоверная генетическая причина заболевания выявлена у 10 пациентов.
Обсуждение
Несмотря на интенсивное изучение ГКМП, на сегодняшний день не выявлено безусловных закономерностей, свидетельствующих об однозначном взаимовлиянии типа генетического дефекта (гена и мутации), варианта анатомического фенотипа, скорости прогрессирования и риска ВСС. Однако можно считать установлен- ным тот факт, что ранняя манифестация типичных клинических симптомов в молодом возрасте делает прогноз ГКМП очень серьезным и нуждается в принятии неотложных лечебных мероприятий [2-6].
Именно эти наблюдения послужили основанием к выполнению настоящего исследования: оценка генотипа, фенотипа и клинических проявлений ГКМП с манифестацией в детском и молодом (до 30 лет) возрасте. Полученные результаты позволили выявить ряд закономерностей, которые могут играть существенную роль в формировании лечебной тактики, выборе хирургической техники и вероятном прогнозе у этой, без сомнения, особой группы пациентов с ГКМП.
Ранние значимые и угрожающие клиниче- ские проявления ГКМП у детей и молодых пациентов в своей основе часто имеют совершенно особый фенотип заболевания, который мы обозначаем как диффузно-генерализованный. Частота этого фенотипа среди юных больных составила 81%. Диффузно-генерализованный фенотип представлен диффузной гипертрофией всей МЖП от базальных отделов до верхушки ЛЖ, увеличением числа и повышенной гипертрофией папиллярных мышц, их смещении к верхушке, удлинением створок МК со смещением зоны их коаптации в полость ЛЖ, нередко гипертрофией передней стенки ЛЖ, избыточной трабекулярностью (и гипертрофией) верхушки. Толщина МЖП часто превышает 35-40 мм, а в одном из наблюдений она даже достигала 55 мм (у пациента 14 лет) в средней трети. В уменьшение полости ЛЖ заметный вклад вносит увеличение количества гипертрофированных папиллярных мышц. Однако наличие нескольких папиллярных мышц скорее следует относить к варианту анатомии [7] и особенностям эмбриогенеза сердца, возможно, также связанным с теми же генетическими изменениями, которые постнатально ведут к гипертрофии миокарда.
В норме такой вариант анатомии папиллярных мышц наблюдается достаточно редко, не сопровождается их гипертрофией и практически ни- когда не ведет к заполнению всей полости ЛЖ и нарушению фазы диастолического наполнения. Следствием такой измененной внутрижелудочковой анатомии является двухуровневый перепад давления и, что самое главное, выраженная облитерация полости ЛЖ, практически полная в систолу. Если к этому добавляется эндомиокардиальный фиброз с потерей лузитропной функции миокарда, то развитие и прогрессирование диастолической дисфункции и сердечной недостаточности неминуемо. Несмотря на то что септальная алкогольная абляция является эффективной малоинвазивной методикой коррекции ГКМП, и интерес к ней вновь вырос в последние десятилетие, наши данные должны использоваться эндоваскулярными специалистами для тщательного отбора пациентов. Это уменьшит процент неэффективных процедур и улучшит суммарные отдаленные результаты эндоваскулярных вмешательств. Выявление таких особенностей, на наш взгляд, является показанием для ранней открытой хирургической операции и для исключения из лечебных мероприятий алкогольной абляции у этой категории пациентов [8, 9]. Именно у этих пациентов, вероятно, со временем формируются показания для пересадки сердца при переходе ГКМП в дилатационную КМП или при невозможности выполнения радикальной расширенной миоэктомии[10].
К характеристике этого фенотипа следует добавить, что створки МК имеют гистологические изменения, свидетельствующие о процессе соединительнотканной дисплазии (этот процесс почти всегда является системным), а формирование внутрижелудочкого перепада давления второго уровня позволяет говорить о субмитальной форме ГКМП.
Тактика операции при такой анатомии ГКМП должна обеспечивать, на наш взгляд, не только устранение перепада давления, но и увеличение общей полости ЛЖ. Первое достигается путем расширенной трансаортальной миоэктомии до основания передней папиллярной мышцы, а второе - либо за счет папиллэктомии и париетальной резекции папиллярных мышц с одновременным иссечением трабекул верхушки трансмитральным либо (при выраженной гипертрофии верхушки) чрезверхушечным доступом [11-16].
Спектр выявленных генетических изменений необычен. Согласно многочисленным исследованиям, в общей когорте больных с ГКМП наиболее часто мутации выявляются в генах MYH7 и MyBPC3, с небольшим доминированием MYH7-опосредованных форм [2]. В нашем пилотном исследовании из 9 человек с мутациями в генах саркомерных белков миокарда подавляющее большинство генетических находок пришлось на ген MyBPC3. Важным на- блюдением считаем тот факт, что у 2 пациентов с диффузно-генерализованным фенотипом были выявлены по 2 клинически значимых генетических варианта (мальчики, оба оперированы в 15 лет), а у 1 больного, также с диффузной формой ГКМП, дополнительно выявлена лейденовская мутация в гене F5 (оперирован в 25 лет). Это наблюдение согласуется с опубликованными данными о том, что присоединение дополнительного генетического фактора связано с более ранней манифестацией и быстрым прогрессированием заболевания, а также может быть ассоциировано с дополнительными рисками в послеоперационном периоде (тромбоэмболическими осложнениями).
Заключение
Без сомнения, необходимы дальнейшие наблюдения в отдаленном послеоперационном периоде, чтобы оценить эффективность хирургии у этой нестабильной группы пациентов. Наличие пациентов с таким фенотипом лишает смысла сравнение результатов открытой хирургии и септальной алкогольной абляции: рандоми- зация сравниваемых когорт без учета фенотипа некорректна и чревата ошибочными выводами. Уже сейчас можно уверенно говорить, что ранняя манифестация ГКМП указывает на особый вариант генотипа и фенотипа, при котором сердечный изолированный фенотип часто дополнен генетическими факторами или носит синдромальный характер. Связи между типом, локализацией мутации и клиническим фенотипом еще предстоит установить [17]. Уже сегодня такое стремление закономерно в классификации MOGE (S) [18].
Надеемся, что предложенная нами простая и компактная классификация анатомических вариантов ГКМП будет полезна всем специалистам и прежде всего оперирующим хирургам при выборе лечебной тактики пациентов с ГКМП.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Сотрудники Луганского республиканского центра экстренной медицинской помощи и медицины катастроф (ЦЭМПМК) в ходе проводимых в Республике тренировочных мероприятий отработали на базе Центра оказание первой неотложной помощи условно пострадавшим в результате техногенной катастрофы.
В соответствии с указанием главы Луганской Народной Республики Леонида Пасечника, с 5 по 9 ноября в Республике проводится совместная с МЧС Донецкой Народной Республики работа органов управления и сил гражданской защиты в рамках Единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций.

"Министерство здравоохранения ЛНР совместно с МЧС ЛНР проводит тренировочные мероприятия с 5 по 9 ноября с целью закрепить практические навыки не только в медицинской сфере, а еще и спасательной. Закрепить свои навыки, закрепить план эвакуации, в какой последовательности нужно спасать людей, как их отсортировать по тяжести состояния. С этой целью мы проводим такие занятия, чтобы все ведомственные силы были между собой скооперированы и могли оказать максимальную помощь, эффективную в этой ситуации", — рассказал инструктор учебно-тренировочного отдела Школы медицины катастроф Роман Цмыкал.
"Мы проводим совместное обучение со своими коллегами по оказанию первой неотложной помощи. Как видите, ежедневно мы тренируемся для того, чтобы быть готовыми ко всему, что может у нас случиться в нашей жизни и наших рабочих моментах, поэтому мы проводим такие ежедневные занятия", — добавил он.

Цмыкал отметил, что параллельно с работой в рамках Единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций на базе ЦЭМПМК проводится ежедневное обучение по оказанию первой неотложной медицинской помощи.
"В целом, это все делается для того, чтоб люди были готовы к любому техногенному случаю. Либо это какая-то авария на предприятии, либо это пострадавший человек на улице — еденичный случай, то есть человек должен быть готов к любому моменту в этом плане", — подчеркнул инструктор.
Ранее сегодня Сотрудники Министерства инфраструктуры и транспорта ЛНР совместно с представителями МЧС, Министерства строительства и ЖКХ и Министерства внутренних дел ЛНР отработали практические действия по восстановлению конструкций условно поврежденного железнодорожного моста.
ВИДЕО ПРИЛАГАЕТСЯ:











