Новости
Для полного исчезновения некачественных и контрафактных препаратов реализуется проект по их маркировке. Сейчас отслеживается движение более 18 млн упаковок почти 2 тысяч препаратов. За время работы система позволила вскрыть правонарушения на сумму свыше 500 млн рублей, отметила Скворцова.
Эксперимент по маркировке лекарств в России проводится с 2017 года. Нанесение маркировки на все без исключения обращающиеся в стране препараты должно было стать обязательным с 1 января 2019 года. Однако из-за неоднократно высказываемых участниками индустрии опасений срыва этого дедлайна тотальное подключение производителей к системе маркировки отложили до 2020 года.
В конце декабря 2018 года премьер-министр Дмитрий Медведев подписал ряд правительственных документов, одним из которых утверждалось: лекарства для лечения высокозатратных нозологий должны начать маркировать с 1 октября 2019 года. Тогда же ЦРПТ был назначен единственным оператором мониторинга движения лекарственных средств.
В апреле 2019 года Госдума приняла законопроект об установлении административной ответственности за продажу препаратов без специальной маркировки. Юридическим лицам и индивидуальным предпринимателям будет грозить штраф до 100 тысяч рублей.
Подробнее: https://vademec.ru/news/2019/04/24/skvortsova-v-2018-godu-dolya-nedobrokachestvennykh-lekarstv-v-obrashchenii-snizilas-na-19/
ШАГ 1: ОПРЕДЕЛИТЕ ОСОБЕННОСТИ ОСТРОГО ПРИСТУПА
Международные руководящие принципы определяют приступ астмы как «острое или подострое ухудшение симптомов и функции легких от обычного состояния пациента или, в некоторых случаях, первоначального проявления астмы». Термин «обострение» часто используется в научной литературе, но пациенты и врачи могут использовать такие слова, как «атака», «эпизод» или «вспышка». Термин «атака» используется в руководстве по астме от Британского торакального общества и Шотландской сети межвузовских рекомендаций (BTS/SIGN).
Определение диагноза, когда ребенок испытывает острую астму, может быть сложной задачей. Манифестация сильно варьирует в зависимости от возраста ребенка. У детей в возрасте от пяти лет и ниже часто встречается рецидивирующее свистящее дыхание, вызванное вирусными инфекциями верхних дыхательных путей. В таких случаях трудно решить, является ли это ранним проявлением астмы. Детям старшего возраста, по-прежнему нельзя поставить устойчивый диагноз астмы. Поэтому мы используем термин «свистящее дыхание/приступ астмы», чтобы указать, что у ребенка может не быть окончательного диагноза астмы.
Раннее распознавание
Большинство приступов свистящего дыхания/астмы развивается в течение одного-двух дней. Это означает, что при раннем распознавании приступа есть возможность начать раннее лечение и при необходимости срочно обратиться в больницу, что может помочь предотвратить прогрессирование приступа. Дети с низкой насыщенностью кислородом (до 92%) или с другими особенностями тяжелого или угрожающего жизни приступа нуждаются в срочном направлении в больницу на скорой помощи; см. шаг 2 для более подробной информации.
Дети старше пяти лет
Старшие дети и подростки поступают с аналогичными взрослым пациентам признаками астмы. Симптомы и признаки включают:
- Прогрессивное увеличение симптомов одышки, кашля, свистящего дыхания и/или чувствительности груди
- Прогрессивное снижение функции легких (например, пикового экспираторного потока по сравнению с предыдущими или прогнозируемыми значениями)
- Затрудненная речь
- Учащение пульса
- Повышенная частота дыхания с использованием вспомогательных мышц дыхания
- Снижение сатурации кислорода.
Дети от одного до пяти лет:
Младенцы и дети дошкольного возраста часто поступают в более непонятными симптомами, чем дети старшего возраста, а родители/опекуны сообщают о симптомах, связанных с инфекциями верхних дыхательных путей, такими как насморк, кашель и шумное дыхание, прежде чем они заметят какое-либо свистящее дыхание. Кроме того, то, что понимают родители под «свистящим дыханием», часто отличается от того, что понимают под этим термином врачи. Родители часто используют термин «свистящее дыхание» для любого шума, поступающего из дыхательных путей. Поэтому важно рассмотреть возможные дифференциальные диагнозы, особенно в этой возрастной группе (см. раздел «Изучение» ниже).
Ранние симптомы приступов свистящего дыхания/астмы у детей дошкольного возраста могут включать:
- Увеличение свистящего дыхания и затрудненное дыхание
- Увеличение кашля, во время сна
- Вялость или сниженная толерантность к физической нагрузке
- Нарушение повседневной деятельности, включая кормление
- Слабая реакция на лекарство, если у ребенка диагноз астмы.
Многие дети дошкольного возраста не имеют анамнеза предыдущих приступов астмы/свистящего дыхания. Даже если у детей были предыдущие приступы свистящего дыхания, вызванные инфекцией верхних дыхательных путей, у большинства из них будет мало или вообще нет респираторных симптомов, таких как свистящее дыхание или одышка, между приступами. Эти интервальные симптомы становятся более частыми по мере взросления детей.
Дети до года
Вам следует подумать о том, чтобы направить детей с острым свистящим дыханием, которые в возрасте до одного года находятся в больнице, если у них есть признаки респираторного дистресса, включая низкую сатурацию (до 92%), повышенную работу дыхания или снижение питания. Значительная часть детей в возрасте до одного года будет иметь бронхиолит и нуждается только в осмотре в больнице, если у них есть признаки респираторного дистресса. После осмотра в больнице, лечение детей с острым свистящим дыханием должно проходить под первоначальным руководством консультанта по неотложной медицине, при необходимости надо обсуждать лечение с общим педиатрическим консультантом.
Дифференциальная диагностика
Возраст ребенка в сочетании с подробным анамнезом от родителей обычно помогает исключить другие причины острого респираторного дистресса.
Вот некоторые важные дифференциальные диагнозы для рассмотрения. Следует иметь в виду, что астма/острое свистящее дыхание могут сосуществовать с рядом диагнозов:
Частые
- Бронхиолит: возникает у детей в возрасте до двух лет и чаще всего на первом году жизни, достигая пика между тремя и шестью месяцами. Симптомы включают продромальную стадию простуды, длительностью от одного до трех дней, сопровождаемую постоянным кашлем, а также тахипноэ или рецессию в грудной клетке (или и то и другое) и либо свистящее дыхание, либо хрипы на аускультации груди (или и то и другое)
- Пневмония: ребенок может иметь очаговые звуки дыхания, притупление при перкуссии и лихорадку
- Круп: характерное внезапное начало, лающий кашель, часто сопровождаемый стридором и втяжение грудной стенки или грудины
- Судорожный кашель (коклюш):характерный кашель, хотя он может не проявляться у детей младшего возраста
Редкие
- Aнафилаксия:крапивница и признаки обструкции верхних дыхательных путей; ребенок может быть подвергнут воздействию возможного или известного анафилактического стимула
- Аспирация инородного тела:симптомы обычно возникают очень внезапно у ребенка, который раньше был здоровым; могут присутствовать звуки с пониженным дыханием с одной стороны
- Врожденные аномалии (трахео- или бронхомаляция):хроническое или прерывистое свистящее дыхание с рождения у ребенка в возрасте до 12 месяцев
- Пневмоторакс:может осложнить приступ астмы; могут быть признаки снижения поступления воздуха и гиперрезонансный звук при перкуссии.
ШАГ 2: ОЦЕНИТЕ СЕРЬЕЗНОСТЬ ПРИСТУПА
Как только ребенок идентифицирован как имеющий острый приступ свистящего дыхания/астмы, следующим важным шагом будет точная оценка тяжести приступа. Это будет способствовать начальному лечению, последующему управлению и планированию выписки (из больницы). Острый приступ может быть легким, умеренным, тяжелым или опасным для жизни по тяжести.
Клинические признаки могут плохо коррелировать с серьезностью обструкции дыхательных путей, у некоторых дети с тяжелым приступом может быть сложно определить дистресс. Время и интенсивность свистящего дыхания не являются хорошими показателями тяжести. Двухтональные свистящие хрипы (как на вдохе, так и на выдохе) или менее выраженнее свистящие хрипы, с тихой грудной клеткой, могут указывать на прогрессию обструкции дыхательных путей. Тихая грудная клетка является признаком приступа, угрожающего жизни. Все дети с особенностями тяжелой или угрожающей жизни атаки должны быть госпитализированы неотложно.
Более надежными факторами для оценки тяжести приступа свистящего дыхания/астмы являются:
- Общий вид
- Степень возбуждения
- Уровень сознания
- Частота дыхания
- Дыхательная попытка (например использование дополнительных мышц шеи, рецессия грудных мышц)
- Частота пульса
- Пульсоксиметрия.
Любой из этих параметров, взятый отдельно, не является конкретным или надежным при оценке тяжести острого приступа; однако в сочетании они дают ценные рекомендации при оценке тяжести.
Таблица 1 основана на нескольких ключевых рекомендациях и показывает, как параметры могут быть использованы для оценки тяжести острого приступа свистящего дыхания/астмы. Детям любой из этих категорий может потребоваться направление в больницу, если они плохо реагируют на первоначальное лечение.
Если у ребенка есть признаки и симптомы разных категорий, лечите в соответствии с наиболее серьезными особенностями.
Таблица 1. Оценка тяжести острых приступов свистящего дыхания/астмы у детей в возрасте 12 месяцев и старше. Основано на руководствах BTS/SIGN, руководство глобальной инициативы по борьбе с астмой (GINA), и руководства Королевской детской больницы Мельбурн по острой астме.
| Тяжесть | Mаркеры тяжести |
|---|---|
| Легкая | Нормальное психическое состояние (нет возбуждения или тревоги)Возможность говорить нормальноПредпочитает сидеть, а не лежатьСкрытая или не увеличенная работа дыхания (без вовлечения дополнительных мышц и без признаков рецессии грудной стенки)Сатурация кислорода (SpO2) ≥92% |
| Умеренная | Нормальное психическое состояние (нет возбуждения или тревоги)Некоторое ограничение способности говоритьПредпочитает сидеть, а не лежатьНекоторая повышенная работа дыхания (вовлечение вспомогательных мышц и/или рецессии грудной клетки)SpO2 ≥92%Частота пульса:≤140/мин у детей от одного до пяти лет≤125/мин у детей старше пяти летЧастота дыхания:≤40/мин у детей от одного до пяти лет≤30/мин у детей старше пяти летПиковой експираторный поток (ПЕП) ≥50% личного или лучшего прогноза (у детей старше пяти лет, которые могут закончить тест правильно) |
| Тяжелая | SpO2 ниже 92% плюс что нибудь из следующего: Ажитация и/или дистрессУмеренная – отмеченное увеличение работы дыхания (вовлечение вспомогательных мышц и/или рецессии грудной клетки)Отмеченное ограничение способности говорить: не может завершить предложения на одном дыхании, слишком запыхается, чтобы говорить или естьСидит сгорбившись впередЧастота пульса:Выше 140/мин у детей в возрасте от одного до пяти летВыше 125/мин у детей старше пяти летЧастота дыхания:Выше 40/мин у детей в возрасте от одного до пяти летВыше 30/мин у детей старше пяти летПЕП от 33 до 50% личного наилучшего или прогнозируемого |
| Жизнеугрожающая/критичная | Любой один из следующих у ребенка с тяжелой астмой:Спутанность сознания и/или сонливостьМаксимальная работа дыхания (вовлечение вспомогательных мышц и/или рецессии грудной стенки)ПЕП менее 33% лучших или прогнозируемых значенийИстощениеНевозможно говоритьБеззвучная грудная клетка (при наличии плохого входа воздуха свистящее дыхание может отсутствовать)ЦианозПлохое дыхательное усилиеГипотония |
Вы всегда должны измерять насыщение кислородом с помощью пульсоксиметра. Уровень менее 92% на воздухе после назначения коротко действующего β2-агонистического лечения выделяет группу детей с более тяжелой астмой, нуждающихся в срочном обращении в больницу. Поэтому жизненно важно, чтобы в вашей семейной практике был пульсоксиметр, подходящий для детей/младенцев.
Пиковый экспираторный поток (ПЕП) можно использовать в качестве дополнительного объективного теста для оценки тяжести острого приступа свистящего дыхания/астмы у детей старше пяти лет, которые могут правильно выполнить тест. ПЕП менее 50% от прогнозируемого значения или наилучшего предыдущего значения, при плохом улучшении после первоначального лечения может прогнозировать более продолжительный приступ. Дети в возрасте до пяти лет, как правило, не могут надежно выполнять маневр пикового потока.
Оценка одышки у детей
У достаточно взрослых, чтобы говорить, детей выявите неспособность сказать предложения на одном дыхании. У детей, которые еще не могут говорить, прерывание крика для дыхания или неспособность завершить кормление, указывает на одышку.
У детей дошкольного возраста, особенно у детей в возрасте до двух лет, часто бывает трудно оценить степень одышки, и основными симптомами могут быть возбуждение и стресс. В этой ситуации вам, возможно, придется полагаться на другие параметры, такие как пульсоксиметрия.
Выявление детей с высоким риском более тяжелого приступа
При оценке острого свистящего дыхания у ребенка всегда проверяйте их прошлый анамнез респираторных заболеваний; в частности, есть ли какая-либо предыстория свистящих приступов или симптомов свистящего дыхания между приступами?
Анамнез одного или нескольких тяжелых приступов идентифицирует когорту пациентов, которая подвержена риску подобных тяжелых событий в будущем, даже если во время первоначальной оценки их маркеры тяжести были мягкими. Прием в больницу и потребность в внутривенных препаратах для лечения астмы означают серьезный приступ. Дети с прошлым анамнезом поступления в отделение интенсивной терапии с острыми свистящими эпизодами с поддержкой или без вентиляционной поддержки были идентифицированы как те, кто подвергается особому риску развития дальнейших угрожающих жизни приступов свистящего приступа.
Вы должны учитывать прошлый анамнез тяжелых и/или угрожающих жизни приступов при оценке соответствующего планирования лечения и выписки, и это не должно зависеть от тяжести при текущей оценке. У вас должен быть низкий порог для направления на вторичный уход для дальнейшего обзора и наблюдения для этих пациентов.
ШАГ 3: РАССМОТРИТЕ СРОЧНОЕ НАПРАВЛЕНИЕ В БОЛЬНИЦУ; ДАЙТЕ КИСЛОРОД, Β2-АГОНИСТ КОРОТКОГО ДЕЙСТВИЯ И СТЕРОИДЫ
Ключевыми видами лечения при первоначальном лечении острой астмы/свистящего дыхания на первичной медико-санитарной помощи являются:
- Кислород
- Ингаляция короткодействующего β2-агониста
- Пероральные кортикостероиды.
Тем не менее, не каждый ребенок будет нуждаться во всех этих методах лечения, и лечение необходимо отрегулировать в соответствии с тяжестью приступа и ответом на лечение.
Следующие группы детей нуждаются в срочной передаче в больницу в машине скорой помощи:
- Дети с низкой сатурацией (до 92%) или с другими особенностями тяжелой или угрожающей жизни атаки.
- Дети с плохой реакцией на первоначальное лечение с постоянными признаками и симптомами после лечения β2-агонистами.
У детей с анамнезом астмы, у которых уже есть индивидуальный план действий по астме (PААP), многие родители/воспитатели начинают лечение астмы дома. Это необходимо учитывать при принятии решения о лечении и оценке реакции в хирургии или в больнице.
Дети с более мягкими приступами обычно могут лечиться в условиях первичной медико-санитарной помощи, в зависимости от ресурсов и опыта.
Кислород
- Вы должны использовать пульсоксиметр для измерения насыщения кислородом у всех детей с острым приступом
- Многие дети с мягким/умеренным приступом будут иметь нормальный уровень насыщения кислородом (≥94%). Этим детям не нужна кислородная терапия
- Если у ребенка низкая насыщенность кислородом (до 94%) или у вас серьезный или угрожающий жизни приступ, вы должны дать им кислород. Используйте плотно прилегающую маска для лица или носовую канюлю с потоком, скорректированным по мере необходимости, чтобы поддерживать целевое насыщение от 94% до 98%
- Низкая сатурация после первоначального лечения обнаруживаются у детей с более тяжелой астмой
Ингаляция β2-агонистов короткого действия
- Ингаляция короткого действующих β2-агонистов является первой линией лечения острой астмы у детей и полезна даже у очень маленьких детей
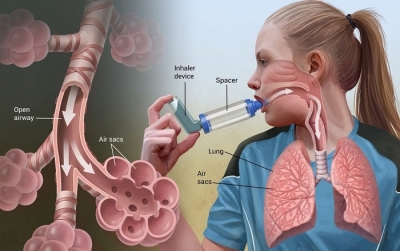
- Дозирующий ингалятор под давлением (pMDI) и спейсер являются предпочтительными методами доставки препаратов для детей с мягкой и умеренной астмой, и столь же эффективны, как и небулайзер для лечения умеренного приступа
- Было обнаружено, что β2— агонисты, полученные с помощью pMDI и спейсера, имеют меньше побочных эффектов, таких как тахикардия и гипоксия, чем при введении через воздушный компрессорный небулайзер (то есть домашний небулайзер, который не приводится в действие кислородом)
- Маска для лица обычно должна быть прикреплена до спейсера для детей в возрасте до трех лет
- Доза β2-агониста должна корректироваться в зависимости от тяжести приступа и ответа на лечение. Для легкого приступа может быть достаточно двух-четырех ингаляций; может потребоваться до 10 ингаляций для более тяжелых приступов
- Наиболее часто используемым β2— агонистом является сальбутамол в дозе 100 мкг/нажатии, и наш совет здесь относится к составу 100 мкг/нажатие, доставленному через pMDI плюс спейсер для острого приступа.
- Если у ребенка тяжелый жизнеугрожающий приступ, вы должны дать им β2-агонист (сальбутамол) через кислородный небулайзер
- Облегчение симптомов должно длиться от трех до четырех часов. Если родители лечат своих детей дома, сообщите им, что если симптомы вернутся в течение трех-четырех часов, дальнейшая большая доза β2 -агониста (до 10 ингаляций спейсером) может быть повторена, пока родители ищут неотложную медицинскую помощь
- Частые, высокие дозы ингаляционного β2-агониста являются безопасными, хотя в результате у детей обычно будут тахикардия и тремор и они могут быть гиперактивными.
- Дозы до 10 ингаляций не следует давать более чем каждые четыре часа дома, не обращаясь за медицинской помощью.
Пероральные кортикостероиды
- В школьном возрасте раннее использование пероральных кортикостероидов во время приступа астмы может уменьшить госпитализацию и предотвратить рецидивы. Выгоды можно увидеть через три-четыре часа после назначения препарата
- У детей дошкольного возраста роль пероральных кортикостероидов менее определена. Большое рандомизированное контролируемое исследование детей дошкольного возраста в Великобритании с мягкими и умеренными свистящими хрипами, которые лечились пять дней пероральным преднизолоном, не показало сокращения госпитализации или других исходов. Настоящий совет заключается в том, что дети дошкольного возраста с тяжелым приступом должны получать пероральный преднизолон
- Дети с легкими и средними приступами, которые имели хороший ответ на β2 -агонисты, могут лечиться с использованием только β 2-агонистов.
- Текущие руководства рекомендуют пероральный преднизолон (таблица 2), хотя в руководстве BTS/SIGN также представлены исследования с использованием однократной дозы дексаметазона, и поэтому эта рекомендация может измениться в будущем
Таблица 2. Дозы перорального преднизолона.
| Возраст ребенка | Доза преднизолона |
|---|---|
| Младше двух лет | 10 мг |
| От двух до пяти лет | 20 мг |
| Старше пяти лет | от 30 мг до 40 мг |
- Детям, которые обычно принимают стероидные таблетки каждый день для их хронического лечения, могут потребоваться большие дозы во время острого приступа, до 2 мг/кг/день (максимум 60 мг)
- Если ребенка рвота при приеме стероидов, дозу следует повторить, и если рвота продолжается, следует использовать внутривенные стероиды
- Детям, которые уже принимают ингаляционные кортикостероиды или другие препараты для предотвращения приступов, следует рекомендовать продолжать их обычную дозу во время острого приступа даже при получении дополнительного лечения. Исключением для этого являются бронходилататоры длительного действия: их следует прекратить, пока ребенок принимает частые высокие дозы бронходилататоров с коротким действием
- Увеличение дозы ингаляционных кортикостероидов не более чем пять раз неэффективно в лечении острой астмы у детей
- Лечение пероральными кортикостероидами на срок до трех дней обычно достаточно, особенно у детей младшего возраста. Старшим детям может потребоваться до пяти дней лечения. Однако продолжительность курса должна быть рассчитана на количество дней, необходимых для восстановления. Сокращение дозировки не требуется для коротких курсов стероидов
КАК ДОСТАВИТЬ Β2-АГОНИСТ С ИСПОЛЬЗОВАНИЕМ СПЕЙСЕРА
Лицевой маской
- Соберите все необходимое: ингалятор, спейсер и маску
- Встряхните ингалятор и прикрепите к спейсеру
- Удостоверьтесь, что ребенок находится в удобном положении (лежа на спине, если новорожденный). Наклоните младенцев до 45 градусов.
- Положите маску на нос и рот ребенка; нажмите очень осторожно, чтобы сделать распыление.
- Нажмите ингалятор один раз и медленно посчитайте до 10 (это займет от 10 до 20 секунд).
- Снимите ингалятор с лица ребенка
- Выньте ингалятор из спейсера.
- Повторите шаги с 2-й по 8-й в соответствии с ответом, максимум до 10 затяжек.
Использование мундштука (без маски для лица)
- Соберите все необходимое: ингалятор и спейсер.
- Встряхните ингалятор и прикрепите к спейсеру
- Убедитесь, что ребенок находится в удобном положении.
- Поместите спейсер в рот ребенка; убедитесь, что вокруг губ есть уплотнение.
- Нажмите ингалятор один раз и посчитайте пять дыханий ребенка.
- Удалите спейсер изо рта ребенка.
- Выньте ингалятор из спейсера
- Повторите шаги с 2 по 8 в соответствии с ответом, максимум до 10 ингаляций
ЛЕЧЕНИЕ ЛЕГКОГО ИЛИ УМЕРЕННОГО ПРИСТУПА
Дети с более мягкими приступами обычно могут лечиться в условиях первичной медико-санитарной помощи с помощью pMDI и спейсера, пока они не будут достаточно стабилизированы, в зависимости от ресурсов и опыта.
Начните первоначальное лечение и оцените ответ.
- Дайте β2-агонист через спейсер+/- маску для лица, по одной ингаляции за один раз, согласно инструкциям выше.
- Дайте максимум 10 ингаляций в любой момент времени.
- Полезно уговорить родителей лечить детей β2-агонистом, так как это позволяет вам проверить технику ингаляции.
- У детей с легким или умеренным приступом только β2-агониста может быть достаточно для лечения симптомов.
- Если симптомы не проходят после 10 ингаляций β2-агониста в одиночку или эффекты не проявляются в течение трех-четырех часов (с указанием более тяжелого приступа), тогда вы должны давать пероральные кортикостероиды.
- Проводите частые клинические наблюдения, включая сатурацию, измеренную датчиком соответствующего размера, для оценки реакции ребенка на лечение. Рассмотрите срочную передачу в больницу, если есть плохой ответ на первоначальное лечение или ухудшение симптомов и/или признаков
ШАГ 4: ОТРЕГУЛИРУЙТЕ ЛЕЧЕНИЕ В ЗАВИСИМОСТИ ОТ ТЯЖЕСТИ ПРИСТУПА И РЕАКЦИИ НА ПЕРВОНАЧАЛЬНОЕ ЛЕЧЕНИЕ
Мониторинг после первичного лечения
После первоначального лечения детей с легким/умеренным приступом вам необходимо следить за ними в течение одного-двух часов. За это время вам нужно следить за:
- Любым улучшением симптомов после β2-агониста
- Любыми признаками тяжелого или угрожающего жизни приступа
- Любыми изменениями частоты дыхания или частоты сердечных сокращений
- Любыми изменениниями насыщения кислородом.
У детей старше пяти лет, привыкших к проведению теста, пиковый выдох может дать дополнительные объективные доказательства реакции на лечение и возвращения к стабильности.
Если ребенку необходимо использовать β 2-агонист больше, чем 10 ингаляций в течение четырехчасового периода, вы должны направить их в больницу.
Вы также должны иметь более низкий порог для направления в больницу, если:
- Ребенок поступил поздним вечером или ночью.
- У них была недавняя госпитализация или предыдущий тяжелый приступ.
- У вас есть опасения по поводу их социальных обстоятельств или их способности справляться дома
Срочное лечение во время ожидания передачи
Дети, которые плохо реагировали на первоначальное лечение или у которых насыщение кислород менее 92%, или у которых есть другие особенности тяжелого или угрожающего жизни приступа, входят в группу высокого риска и должны быть перевезены в больницу скорой помощью. Ожидая передачи, выполните следующие действия:
- Дайте кислород через плотно прилегающую маску для лица или носовую канюлю с потоком, скорректированным по мере необходимости, чтобы поддержать целевое насыщение от 94% до 98%
- Дайте пеероральный преднизолон: постарайтесь начать в течение первого часа медицинской помощи.
- Дайте сальбутамол через небулайзер, управляемый кислородом. Небулайзированный сальбутамол можно повторять каждые 20 минут по мере необходимости.
- Если ответ на начальную дозу небулайзированного сальбутамола плохой, то к каждому последующему распылителю можно добавить ипратропию бромид. Это можно сделать каждые 20-30 минут в течение двух часов.
- Кислород должен всегда назначаться детям с гипоксией (с насыщением кислородом ниже 94%), а лечение сальбутамолом с использованием распылителя с кислородным двигателем следует продолжать по необходимости во время передачи.
- У детей в возрасте до двух лет, которые не могут ответить на сальбутамол, стоит рассмотреть альтернативные диагнозы.
Таблица 3. Краткое изложение начального лечения острых приступов свистящих хрипов/астмы в первичной медико-санитарной помощи.
Тяжесть Первоначальное лечение на первичной помощи Мягкая/Умеренная Давать β2-агонисты короткого действия через спейсер
Рассмотреть кортикостероидные таблетки
Назначить кислород если SpO2 ниже 94%
Рассмотреть срочную передачу в больницу, если есть ответ на первоначальное лечение плохойТяжелая Давать кислород
Давать небулайзированный сальбутамол с помощью распылителя, управляемого кислородом
Давать кортикостероидные таблетки
Организовать срочный перевод в больницуЖизнеугрожающая/ критическая Давать кислород
Давать небулайзированный сальбутамол с помощью распылителя, управляемого кислородом.
Давать кортикостероидные таблетки или внутривенный гидрокортизон при рвоте.
Организовать срочную передачу в больницу.
Если ответ на начальную дозу небулайзированного сальбутамола плохой, добавляют ипратропий бромид к каждой последующей ингаляцииШАГ 5: ОБЕСПЕЧЬТЕ РЕБЕНКА И ЕГО СЕМЬЮ ДОСТАТОЧНОЙ ИНФОРМАЦИЕЙ И ДАЙТЕ ЛЕКАРСТВА, ПРЕЖДЕ ЧЕМ ОНИ ОТПРАВЯТСЯ ДОМОЙ.
До тех пор, пока ребенок хорошо реагирует на первоначальное лечение, не нуждается в госпитализации и получает соответствующую консультацию по вопросам безопасности (см. ниже), для него безопасно вернуться домой, когда β2-агонисты необходимы не более 10 ингаляций в течение четырехчасового периода. Кроме того, насыщение кислородом должно быть больше 94%, и, если доступно, ПЕП или ОФВ1 должно быть больше 75% от лучшего или прогнозируемого показателя. Если ребенку необходимо использовать β2-агонисты больше 10 ингаляций в течение четырехчасового периода, ему необходимо пройти медицинское обследование и мониторинг в больнице.
Если возможно, старайтесь не отправлять детей домой поздним вечером, так как симптомы часто бывают хуже ночью.
Прежде чем отправить семью домой, важно убедиться, что у них правильный ингалятор и подходящий для ребенка этого возраста спейсер, и что они знают, как их использовать. После первоначального лечения острого приступа ребенок должен продолжать применять β2-агонисты, пока симптомы не будут полностью устранены. Родители должны применять β2-агонист pMDI и спейсером, до 10 ингаляций за четыре часа. Стандартный pMDI сальбутамола содержит 200 ингаляций, поэтому важно обеспечить достаточное количество лекарств для продолжения лечения до следующего обзора.
У детей примерно 80% приступов вызваны вирусными инфекциями верхних дыхательных путей («простуда»), особенно риновирусами. В настоящее время бактериальные инфекции не считаются важным триггером. Большинство детей не нуждаются в антибиотике или не получат его. Руководства BTS/SIGN утверждают, что рутинное назначение антибиотиков не показано детям с острой астмой.
Время для разрешения симптомов зависит от характера триггера и степени тяжести приступа, но, вероятно, это займет несколько дней. Пероральные стероиды, если они предписаны, должны быть продолжены до тех пор, пока симптомы не будут устранены: обычно от трех до пяти дней. Клиницист должен рассмотреть ответ в течение этого периода, если потребуется более длительный курс.
Хорошей практикой будет продолжение любого профилактического лечения астмы во время острого приступа. Исключением будут бронходилататоры длительного действия: их следует прекратить, пока ребенок принимает частые высокие дозы бронходилататоров с коротким действием.
Если ребенок отправляется домой, вам следует организовать надзор за ним в течение 48 часов от приступа.
Вы также должны убедиться, что у родителей/опекунов есть персональный план действий по астме (РААР) для их ребенка. PAAP должен включать информацию о том, как лечить текущий приступ, и что делать, если симптомы ухудшаются. Также полезно дать родителям советы о том, как отменить экстренное лечение, применяемое при приступе астмы (см. также шаг 7).
Наконец, вы должны сообщить родителям/опекунам о соответствующей рекомендации по перестраховке, как распознавать и реагировать на продолжающиеся симптомы.
Консультации по вопросам социальной защиты для семей
- Родители/опекуны должны знать о симптомах, которые указывают, что текущее лечение не работает.
- Могут включать необходимость давать β2-агонисты более, чем 10 ингаляций в течение четырехчасового периода, а их ребенок становится более невосприимчивым, проявляя повышенное напряжение при дыхании, или становится необычно сонливым. В этих обстоятельствах посоветуйте родителям позвонить в скорую помощь.
- Множественное дозирование с 10 ингаляций β2-агониста должно обеспечить облегчение симптомов в течение трех-четырех часов.
- Если симптомы повторяются в течение этого периода, родители/опекуны должны дать еще 10 сонливымβ2-агониста через спейсер и обратиться за неотложной медицинской помощью или вызвать скорую помощь. Родителей часто нужно убедить в том, что в этой ситуации безопасно давать 10 ингаляций β2-агониста
ШАГ 6: ОБЕСПЕЧЬТЕ ОБУЧЕНИЕ ПО САМОЛЕЧЕНИЮ И РАЗРАБОТАЙТЕ ИНДИВИДУАЛЬНЫЙ ПЛАН ДЕЙСТВИЙ ПО АСТМЕ
Имеются убедительные доказательства того, что PAAP(Personalised asthma action plans — с анг. Индивидуальные планы действий по лечению астмы) улучшает лечение астмы. Большинство детей по Национальному обзору смертей от астмы никогда не получали PAAP. PAAP должен всегда включать рекомендации об лечении острых приступов, а также подробные сведения о лечении текущим средством для предотвращения, если таковые предусмотрены, и план распознанных триггеров пациента. Данные свидетельствуют о том, что РААР, основанный на симптомах, превосходят РААР, основанный на пиковом потоке, для предотвращения острых ситуаций.
Изучение: что должно быть в индивидуальном плане действий по астме (PAAP)?
PAAP должен включать информацию о:
Борьбе с приступами
- Как определить, когда симптомы ухудшаются?
- Что делать, когда симптомы ухудшаются?
- Что делать в чрезвычайной ситуации?
- Когда и как вызвать экстренную помощь?
Лечение астмы между приступами
- Избегание триггеров, например минимизируя воздействия аллергических триггеров и избегание воздействия табачного дыма в окружающей среде, особенно в домашних условиях
- Возможность использования устройства ингалятора +/- спейсера
- Использование регулярных превентивных препаратов, если они назначены, и по мере необходимости — бронходилататора
Любой приступ астмы является значительным и тревожным событием, которого семьи хотели бы избежать. Тем не менее, приступ содержит «бучающий момент», когда внимание каждого сосредоточено на астме. Было показано, что предоставление письменного РААР в рамках экстренного посещения при астме сокращает использование медицинских ресурсов в чрезвычайных ситуациях, включая посещение отделения неотложной помощи и госпитализацию, а также улучшение маркеров контроля астмы.
Доказательства предполагают, что приступы астмы могут развиваться по-разному у разных детей, но что характер развития, как правило, согласуется с конкретным ребенком. Поскольку большинство астматических приступов развиваются в течение одного-двух дней, выявление ранних предупреждающих признаков может позволить родителям предвидеть приступ и начать раннее лечение. Это означает, что детали того, как развивался недавний приступ, что заметили родители и как они отреагировали, можно использовать в качестве шаблона для планирования того, что должно быть сделано в любом следующем приступе, и важно делиться с коллегами по вопросам первичной и вторичной помощи.
Семьи должны быть четко осведомлены о том, что делать, если приступ астмы развивается, и ребенку не становиться лучше. Они должны знать, что если симптомы у ребенка ухудшаются, или если облегчение от β2-агониста длится менее четырех часов, они должны давать до 10 ингаляций β2-агониста через спейсер и немедленно вызвать скорую помощь.
Семьи также должны знать о мерах по обеспечению безопасности (см. шаг 5). В некоторых случаях может быть полезно репетировать то, что они должны сказать, если они звонят в службы экстренной помощи, или помочь им составить контрольный список.
В случае, если семьям необходимо позвонить к семейному врачу, убедитесь, что они знают, что они четко сообщают вашим регистраторам, что, по их мнению, у ребенка приступ астмы, и что им необходимо срочное обследование у врача или обученной медсестры по астме.
Фибрилляция предсердий (ФП) является важным состоянием, которое поражает от 1 до 2% населения, что приводит к значительной заболеваемости и смертности. У большого количества пациентов ФП не диагностируется и поэтому им не проводят соответствующего лечения, а часть пациентов, которым правильно поставили диагноз, не получает оптимального лечения для снижения риска развития инсульта.Новые пероральные антикоагулянты (НОАК) являются относительно недавними дополнениями к вариантам лечения пациентов с ФП и в настоящее время рекомендованы Национальный институтом здоровья и качества медицинской помощи (NICE) в качестве альтернативы варфарину для профилактики инсульта у некоторых пациентов. Эти рекомендации помогут вам распознать различные проявления фибрилляции предсердий, безопасно и эффективно лечить пациентов.
Фибрилляция предсердий (ФП) представляет собой суправентрикулярную аритмию, характеризующуюся полным отсутствием скоординированных предсердных сокращений. Это наиболее распространенная устойчивая сердечная аритмия, поражающая 1-2% населения, и, как ожидается, по крайней мере удвоится в распространенности в ближайшие 50 лет. С возрастом риск развития ФП составляет примерно 25% у тех, кто достиг 40 лет.
ФП является важным состоянием, поскольку оно ассоциируется со значительно повышенной заболеваемостью и смертностью :
- Симптомы: учащение или нерегулярная частота сердечных сокращений или и то, и другое могут вызывать такие симптомы, как сердцебиение и одышка, которые могут быть неприятными и приводят к снижению толерантности к физическим нагрузкам и ухудшению качества жизни. Многие пациенты не испытывают симптомов
- Риск инсульта: один из пяти инсультов возникает вследствие ФП. Инсульты, ассоциированные с ФП, связаны с более тяжелой нетрудоспособностью
- Сердечная недостаточность: может быть как следствием, так и причиной возникновения ФП. Симптоматическая сердечная недостаточность выявляется у 30% пациентов с ФП, а ФП обнаруживают у 30-40% людей с сердечной недостаточностью
- Показатели смертности: выше у пациентов с ФП, особенно при наличии сопутствующих заболеваний.
Лечение ФП должно быть сосредоточено на пациентах с целью как контроля симптомов (если они есть), так и снижения риска неблагоприятных исходов (в частности, инсульта) путем оценки риска и надлежащего использования методов лечения, основанных на доказательствах.
КАКОВЫ ПРИЧИНЫ ФП?
Существует множество факторов риска и причин развития ФП, но в развитых странах у большинства пациентов ФП возникает на фоне сердечно- сосудистых заболеваний (ССЗ). Таким образом, многие факторы риска ФП ассоциируются с сердечно-сосудистыми заболеваниями и включают мужской пол, старший возраст, курение, диабет, ожирение и гипертонию.
Важно установить, есть ли другая причина ФП, потому что модифицируемые причины повлияют на лечение. Факторы, которые следует учитывать, включают:
- Предыдущий инфаркт миокарда
- Сердечную недостаточность
- Заболевания щитовидной железы
- Злоупотребление алкоголем или препаратами
- Заболевания клапанов сердца (особенно митрального)
- Отягощенный семейный анамнез.
Эхокардиографические предикторы ФП включают:
- Большие предсердия
- Снижение функции желудочков
- Увеличение толщины стенки левого желудочка.
КАК ПРОЯВЛЯЕТСЯ ФП?
Клиническая картина ФП значительно варьируется. Многие пациенты бессимптомны или сообщают о нечетких неспецифических симптомах. Это может означать, что у многих пациентов ФП диагностируется только после того, как у них развиваются серьезные осложнения, такие как инсульт или сердечная недостаточность. Вы должны рассматривать ФП у пациентов, которые поступают с:
- Одышкой
- Сердцебиением
- Обмороками/головокружением
- Дискомфортом за грудиной
- Инсультом/транзиторной ишемической атакой.
Нередко бессимптомная ФП обнаруживается во время рутинного обследования медицинским персоналом, например, при заборе крови при хронических заболеваниях или при измерении пульса при оценке острой болезни. Если для измерения артериального давления используется автоматизированный (осциллометрический) сфигмоманометр, то перед использованием следует пальпаторно оценить пульс пациента, чтобы исключить нерегулярность пульса. Это связано с тем, что эти устройства не валидированы для использования у пациентов с нерегулярным пульсом.
Были призывы ввести национальную программу скрининга ФП, поскольку скрининг на ФП у людей в возрасте 65 лет и старше соответствовал бы критериям Национального скринингового комитета Великобритании. Существуют опасения, что пациенты с ФП, обнаруженные при скрининге, могут иметь более низкие профили риска инсульта (и, следовательно, получат меньше пользы от выявления), чем пациенты, у которых ФП диагностируется с помощью внепланового обследования. Однако, когда профили риска у пациентов с ФП, диагностированной с помощью систематического скрининга, сравнивались с таковыми при ФП, диагностированной во время внепланового осмотра, они оказались сопоставимыми.
ДИАГНОСТИКА И ПЕРВОНАЧАЛЬНАЯ ОЦЕНКА ФП
Неправильный пульс, обнаруженный при пальпации, и последующая характерная картина на электрокардиограмме (ЭКГ), являются типичными для диагностики и первоначальной оценки ФП. Также важно установить, является ли состояние пациента стабильным или нестабильным, симптоматическим или бессимптомным и что может вызывать ФП.
Несколько людей, которые поступили с ФП, могут быть клинически нестабильными. Анамнез и обследование сердечно-сосудистой системы должны идентифицировать пациентов, которые могут нуждаться в срочной оценке на вторичном звене медицинской помощи. Нестабильные пациенты включают больных с:
- Гипотензией
- Признаками декомпенсированной застойной сердечной недостаточности
- Неконтролируемой стенокардией.
У стабильных пациентов с подозрением на ФП после обнаружения нерегулярного пульса необходимо провести ЭКГ. ЭКГ- признаки, которые считаются диагностическими для ФП, включают отсутствуют Р-волн и их замену волнами фибрилляции. Также обычно наблюдается нерегулярный желудочковый ответ в виде вариабельного времени между комплексами QRS.
https://www.eskulap.top/wp-content/uploads/2019/03/fibrilljacija-predserdij-.png" alt="Фибрилляция предсердий" class="wp-image-1645" srcset="https://cdn.shortpixel.ai/client/q_glossy,ret_img,w_944/https://www.eskulap.top/wp-content/uploads/2019/03/fibrilljacija-predserdij-.png 944w, https://cdn.shortpixel.ai/client/q_glossy,ret_img,w_300/https://www.eskulap.top/wp-content/uploads/2019/03/fibrilljacija-predserdij--300x48.png 300w, https://cdn.shortpixel.ai/client/q_glossy,ret_img,w_768/https://www.eskulap.top/wp-content/uploads/2019/03/fibrilljacija-predserdij--768x124.png 768w" sizes="(max-width: 944px) 100vw, 944px" data-pagespeed-url-hash="1114525171" style="box-sizing: border-box; height: auto; max-width: 100%; vertical-align: middle;">
Фибрилляция предсердий: отсутствие Р волн и нерегулярный желудочковый ответПациенты с подозрением на пароксизмальную форму ФП могут иметь нормальную ЭКГ. Для этих пациентов следует использовать 24-часовой амбулаторный ЭКГ-мониторинг, если время между симптоматическими эпизодами составляет менее 24 часов. ЭКГ-регистратор событий может понадобиться пациентам, у которых время между симптоматическими эпизодами составляет более 24 часов.
В зависимости от клинической ситуации могут потребоваться дальнейшие вмешательства. Они могут включать:
- Лабораторные анализы
- Оценку функции щитовидной железы
- Общий анализ крови
- Креатинин сыворотки
- Анализ мочи на наличие протеинурии
- Анализы на сахарный диабет (HbA1c)
- Трансторакальную эхокардиографию (ТТЭ)
- Если есть подозрение на наличие основного структурного или функционального заболевания сердца (например, сердечная недостаточность или сердечный шум)
- Если рассматривается стратегия контроля частоты сердечных сокращений, включающая кардиоверсию
- Если исходная эхокардиография важна для долгосрочного лечения
- Транспищеводная эхокардиография (ТПЭ)
- Если ТТЭ демонстрирует аномалии, которые требуют дальнейшей оценки
- Если ТТЭ является технически сложной или сомнительного качества, и существует необходимость исключить сердечные аномалии
- Если рассматривается кардиоверсия с использованием ТПЭ.
ПРИНЦИПЫ ЛЕЧЕНИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Основные принципы лечения ФП основаны на том, чтобы предложить пациенту индивидуальный пакет помощи. NICE предполагает, что он должен включать:
- Осведомленность об инсульте и меры по его профилактике
- Примеры осведомленности об инсульте включают информацию о симптомах инсульта и о том, как ФП может привести к инсульту
- Меры по профилактике инсульта включают проведение антикоагулянтной терапии при ФП
- Контроль ритма
- Оценка симптомов для контроля ритма
- К кому следует обращаться за советом, если необходимо
- Психологическая поддержка при необходимости
- Обновленное и всестороннее образование и информация о:
- Причине, последствиях и возможных осложнениях ФП
- Контроле частоты сердечных сокращений и ритма
- Сетях поддержки антикоагулянтной терапии (таких как сердечно-сосудистые благотворительные организации).
Приоритеты и стратегии для отдельных пациентов будут различаться. Некоторые из них получат пользу от кардиоверсии и восстановления синусового ритма, тогда как для многих пациентов вполне приемлемо состояние ФП при условии, что контролируется частота сокращений желудочков и проводится профилактика инсульта.
Нет никаких текущих доказательств того, что контроль ритма превосходит контроль частоты сердечных сокращений в профилактике инсульта или снижении смертности. Важные соображения касаются того, контролируются ли симптомы, а риск инсульта сводится к минимуму.
Если на любом этапе лечения не удается контролировать симптомы или требуется более специализированное лечение, необходимо немедленно направить (не более четырех недель) пациента к кардиологу.
КОНТРОЛЬ ЧАСТОТЫ СЕРДЕЧНЫХ СОКРАЩЕНИЙ И РИТМА: МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Контроль частоты сердечных сокращений должен быть стратегией первой линии для лечения симптомов у пациентов с ФП, и пароксизмальной (снижение частоты сокращения желудочков во время пароксизмов), и персистирующей форм. Пациентам следует назначить стандартный бета-блокатор (не соталол) или снижающий частоту блокатор кальциевых каналов в качестве начальной монотерапии для снижения частоты сердечных сокращений и контроля симптомов ФП. Вы должны основывать выбор препарата на симптомах, частоте сердечных сокращений, сопутствующих заболеваниях и предпочтениях пациента.
Для пациентов, которые ведут малоподвижный образ жизни и имеют не пароксизмальную форму ФП, вы можете рассматривать монотерапию дигоксином как лечение первой линии. Это объясняется тем, что дигоксин эффективен только для контроля частоты сокращений желудочков в состоянии покоя. Если симптомы пациента не контролируются при монотерапии, и вы считаете, что они вызваны плохим контролем частоты сокращений желудочков, рассмотрите комбинированную терапию двумя препаратами из следующих:
- Бета-блокатор
- Дилтиазем (нелицензированный для показаний в Великобритании)
- Дигоксин.
Если пациент по-прежнему симптоматичен при комбинированной терапии, следует рассмотреть возможность лечения для контроля ритма. Оно может быть медикаментозное или электрическое или и то, и другое. Медикаментозное лечение для долгосрочного контроля ритма может потребоваться людям с пароксизмальной формой ФП, чтобы максимизировать время при синусовом ритме или после кардиоверсии у людей, у которых, как считается, может возникнуть рецидив, чтобы увеличить вероятность сохранения синусового ритма.
Если требуется лечение препаратами для контроля ритма, в первую очередь следует использовать стандартный бета-блокатор (не соталол). Если это не позволяет контролировать ритм, тогда препаратами выбора терапии второй линии являются дронедарон, амиодарон, флекаинид или пропафенон. Обычно их применение начинают кардиологи. Некоторых пациентов (с нечастыми пароксизмами и несколькими симптомами) можно лечить, избегая провоцирующих факторов (таких как кофеин или алкоголь), или с помощью стратегии «таблетка в кармане».
КОНТРОЛЬ ЧАСТОТЫ СЕРДЕЧНЫХ СОКРАЩЕНИЙ И РИТМА: НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Для некоторых пациентов приемлемым может быть проведение электрической кардиоверсии. Пациентам с ФП с высокой частотой сердечных сокращений, которые гемодинамически нестабильны (тахикардия, гипотензия, признаки кардиогенного шока), может потребоваться срочная кардиоверсия. Для пациентов с симптоматической ФП, у которых симптомы возникли течение 48 часов, также может быть приемлемым проведение ранней электрической кардиоверсии. Если симптомы присутствуют более 48 часов и рассматривается кардиоверсия, пациент должен принимать терапевтическую дозу антикоагулянта не менее трех недель до кардиоверсии.
Если стратегии контроля ритма не были успешными или не приемлемыми для пациента, можно рассмотреть абляцию предсердий или «водитель ритма и абляцию» (постановку кардиостимулятора с абляцией АВ-узла).
ПРОФИЛАКТИКА ИНСУЛЬТА У ПАЦИЕНТОВ С ФП
Профилактика инсульта является ключом к улучшению исходов у пациентов с ФП. Риск инсульта и кровотечений необходимо оценивать у ВСЕХ пациентов с симптоматической или бессимптомной ФП (пароксизмальной, персистирующей или постоянной формой). Оценка риска также должна проводиться для пациентов с трепетанием предсердий или пациентов с постоянным риском аритмий после кардиоверсии.
Антикоагулянтная терапия значительно снижает риск развития инсульта вследствие ФП, но может привести к геморрагическому инсульту и другим выраженным побочным эффектам. Использование двух систем оценки позволит вам помочь пациентам оценить риски и преимущества антикоагулянтной терапии и принять решение о лучшем метода лечения. Они включают :
ОЦЕНКА РИСКА ИНСУЛЬТА
До недавнего времени шкала CHADS2 в общем была посвящена оценке риска развития инсульта у людей с ФП. Этот инструмент выделяет один балл за каждый пункт: хроническую сердечную недостаточность, гипертонию, возраст старше 75 лет и сахарный диабет; а также два балла за наличие в анамнезе инсульта или транзиторной ишемической атаки. Тем не менее, как NICE, так и Европейское общество кардиологов теперь рекомендуют использовать инструмент CHA2DS2-VASc. В этой модифицированной версии инструмента CHADS2 включает дополнительные факторы риска (сосудистые заболевания, возраст 65-74 лет и пол), которые помогают идентифицировать людей с низким риском развития инсульта, которые не получат пользы от лечения антикоагулянтами (таблица 1). Шкала CHA2DS2-VASc использует восемь критериев для оценки за 9-балльной системой.
Таблица 1: CHA2DS2-VASc
CHA2DS2-VASc Оценка Хроническая сердечная недостаточность или фракция выброса левого желудочка ≤40% 1 Артериальная гипертензия 1 Возраст ≥75 лет
Возраст 65-74 года
2
1
Сахарный диабет 1 Инсульт или транзиторная ишемическая атака 2 Пол (женщины) 1 Сосудистые заболевания 1 Примечание: увеличение показателя представляет собой повышения риска развития инсульта. Оценку можно использовать для оценки риска тромбоэмболического инсульта в год при условии, что пациент не принимает антикоагулянтной терапии (таблица 2). Обратите внимание, что эти факторы риска не являются модифицируемыми.
Таблица 2. CHA2DS2-VASc и риск тромбоэмболического инсульта в год
CHA2DS2-VASc Скорректированный уровень тромбоэмболии в год (%) 0 0,0% 1 1,3% 2 2,2% 3 3,2% 4 4,0% 5 6,7% 6 9,8% 7 9,6% 8 6,7% 9 15,2% Принимая во внимание риск кровотечения (см. ниже), вы должны назначить антикоагулянтную терапию:
- Всем пациентам, у которых показатель по шкале CHA2DS2-VASc составляет 2 или выше
- Мужчинам, у которых показатель по шкале CHA2DS2-VASc 1 (хотя обратите внимание, что у этих пациентов риски и польза от проведения антикоагулянтной терапии могут быть сопоставимыми).
И наоборот, мужчинам, у которых оценка по шкале CHA2DS2-VASc составляет 0, и женщинам с показателем ≤1 (т.е. людям в возрасте до 65 лет без каких-либо факторов риска, кроме пола) не следует назначать антикоагулянтную терапию, так как риск развития инсульта у них низкий.
ОЦЕНКА РИСКА КРОВОТЕЧЕНИЙ
NICE рекомендует использовать шкалу HAS-BLED для :
- Оценки риска кровотечения у людей, которые начинают или начали терапию антикоагулянтами
- Определения, коррекции и контроля модифицируемых факторов риска:
- Неконтролируемой гипертензии
- Сниженной функции почек
- Низкий контроль показателя МНО
- Одновременный прием препаратов, например, одновременное применение аспирина, нестероидного противовоспалительного средства (НПВС) или селективного ингибитора обратного захвата серотонина (СИОЗС)
- Злоупотребление алкоголем.
Используя инструмент HAS-BLED, существует повышенный риск кровотечения в год, если оценка 3 или выше при приеме антикоагулянта (таблица 4).
Обратите внимание, что снижение риска кровотечения у пациента посредством модификации перечисленных выше факторов риска означает, что оценка по HAS-BLED уменьшается на один балл (на каждый измененный фактор риска). Например, контроль гипертонии, улучшение функции почек, перевод пациентов, принимающих варфарин с низким контролем МНО, на NOAC, перевод пациентов, которые принимают препараты, которые увеличивают риск кровотечения, на альтернативные лекарственные средства, и снижение уровней злоупотребления алкоголем, уменьшат показатель HAS-BLED на 1 балл.
Таблица 3. Шкала HAS-BLED для оценки риска кровотечения для пациентов с ФП, принимающих антикоагулянты*
Характеристика Показатель, если присутствует Гипертензия (систолический АД ≥160 мм рт.ст.) 1 Поражение функции почек
Поражение функции печени1
1Перенесенный инсульт 1 Кровотечение 1 Вариабельный показатель МНО 1 Старший возраст (≥65 лет) 1 Прием препаратов (например, аспирин/НПВС) Злоупотребление алкоголем 1 *Проверено только в популяции, принимающей антагонисты витамина К. Таблица 4. Шкала HAS-BLED и риск кровотечения (в течение 1 года в когорте Euro Heart Survey)
Шкала HAS-BLED Кровотечения/100 пациентов в год 0 1,13 1 1,02 2 1,88 3 3,72 4 8,7 5 12,5 6-9 Недостаточно данных Шкала HAS-BLED не должна использоваться, чтобы препятствовать пациентам принимать антикоагулянты. Вместо этого ее следует использовать для оценки того, как можно снизить риск кровотечения, и использовать в комбинации с CHA2DS2-VASc как способ сбалансировать преимущества и риски. При обсуждении рисков и преимуществ антикоагулянтов для пациентов с ФП важно помнить :
- Для большинства людей преимущества антикоагулянтной терапии перевешивают риски
- Для людей с повышенным риском кровотечения преимущества антикоагулянтов могут не всегда перевешивать риск кровотечения, и важно проводить тщательный мониторинг риска кровотечения.
Не отказывайтесь от антикоагулянтной терапии только потому, что человек рискует упасть. В одном из исследований было высказано предположение о том, что человек, принимающий варфарин, должен будет падать примерно 295 раз в год, чтобы риск субдурального кровоизлияния перевешивал преимущества варфарина. Если антикоагулянтная терапия считается наилучшим вариантом для пациента, вы должны обсудить, является ли наиболее подходящим антагонист витамина К (например, варфарин) или новый пероральный антикоагулянт (NOAC) (см. ниже).
Если ваш пациент получит пользу от антикоагулянтов, но пероральные антикоагулянты противопоказаны или не переносятся, то он может быть подходящим кандидатом для окклюзии ушка левого предсердия и вам следует обратиться за консультацией к специалисту.
ОБСУЖДЕНИЕ АНТИКОАГУЛЯНТНОЙ ТЕРАПИИ С ПАЦИЕНТАМИ
После того, как вы объяснили последствия ФП, пациент должен решить:
- Хотят ли они начать антикоагулянтную терапию для профилактики инсульта
- Какой антикоагулянт они хотят принимать.
Легко понять, как это решение может запутать пациентов. Мы пытаемся предотвратить инсульт, используя препараты, которые могут вызвать инсульт. Важно, чтобы ваш пациент полностью осознавал риски и преимущества, чтобы он мог принять правильное решение. Пациент может предпочесть отказаться от помощи для принятия решения пациентом и ему может потребоваться некоторое время, чтобы рассмотреть варианты, прежде чем принимать решение.
ВЫБОР ПОДХОДЯЩЕГО АНТИКОАГУЛЯНТА ДЛЯ ОТДЕЛЬНЫХ ПАЦИЕНТОВ
Как только пациент решил, что антикоагулянтная терапия является наилучшим вариантом профилактики инсульта, ему необходимо рассмотреть, какие именно антикоагулянты следует принимать.
До 2010 года антагонисты витамина К (такие как варфарин) были единственными доступными пероральными антикоагулянтами. В настоящее время в Великобритании лицензированы три NOAC (дабигатран, ривароксабан и апиксабан) для профилактики инсульта и системной эмболии у взрослых с неклапанной фибрилляцией предсердий с по меньшей мере одним дополнительным фактором риска, определяемым как :
- Предшествующие инсульт, транзиторная ишемическая атака или системная эмболия
- Сердечную недостаточность
- Возраст 75 лет или старше
- Возраст 65 лет и старше с диабетом, ишемической болезнью сердца или гипертонией.
Несмотря на незначительные различия в показаниях отдельных препаратов (например, вариации в определениях приема при сердечной недостаточности и группы, для которых они противопоказаны), пациенты с фибрилляцией предсердий, которые ранее принимали варфарин, теперь должны рассматриваться как кандидаты для новых препаратов. Эдоксабан, еще один NOAC, в настоящее время пересматривается NICE с ожидаемым результатом осенью 2015 года.
Нет доказательной базы или рекомендации, которая советует прием одного NOAC больше чем другого для конкретных групп пациентов. Некоторые комментаторы, однако, начинают делать предложения, например, в этом BMJ Современный обзор по антикоагулянтной терапии при фибрилляции предсердий. В таблице 5 приведены показания, способы введения и распространенные побочные эффекты трех NOAC, доступных в настоящее время в Великобритании.
Таблица 5. Сводная информация для NOAC*
Препарат Показания Стартовая доза Распространенные побочные эффекты Дабигатран Профилактика инсульта и системной эмболии у пациентов с неклапанной ФП и по крайней мере одним из следующих факторов риска:
- Предшествующие инсульт,
ТИА или системная эмболия - ФВЛЖ<40%
- Симптоматическая сердечная недостаточность (NYHA класс 2 или выше)
- Возраст ≥75 лет или ≥65 у пациентов с диабетом, ишемической болезнью сердца или гипертензией
- Стандартная доза: 150 мг 2 раза в день
- Пациенты возрастом 75-80 лет: используйте стандартную дозу, но назначайте 110 мг два раза в день для отдельных пациентов, у которых тромбоэмболический риск низкий, а риск кровотечения высок
- Также рассмотрите более низкую дозу 110 мг два раза в день для пациентов с умеренной почечной недостаточностью или повышенным риском кровотечения
- Пациенты >80 лет (повышенный риск кровотечения) или тех, кто одновременно принимает верапамил: 110 мг два раза в день длительно
Анемия, боль в животе, диарея, диспепсия, кровотечение из желудочно-кишечного тракта, кровотечение из мочеполового тракта (пациенты могут заметить кровь в моче), тошнота и кровотечение из носа Ривароксабан Профилактика инсульта и системной эмболии у пациентов с неклапанной ФП и по крайней мере одним из следующих факторов риска:
- Застойная сердечная недостаточность
- Артериальная гипертензия
- Возраст ≥75 лет
- Сахарный диабет
- Предшествующий инсульт или ТИА
20 мг раз в день во время приема пищи Кровотечение, анемия, тошнота, повышение уровня трансаминаз Апиксабан Профилактика инсульта и системной эмболии у пациентов с неклапанной ФП и по крайней мере одним из следующих факторов риска:
- Предшествующий инсульт или ТИА
- Возраст ≥75 лет
- Артериальная гипертензия
- Сахарный диабет
- Симптоматическая сердечная недостаточность
5 мг два раза в день
2,5 мг два раза в день у людей >80 лет с массой тела ≤60 кг
Носовые кровотечения, ушиб, гематурия, гематома, кровоизлияние в глаза и кровотечение из желудочно-кишечного тракта РЕКОМЕНДАЦИИ NICE ДЛЯ ВЫБОРА АНТИКОАГУЛЯНТА
Обновленные рекомендации NICE по лечению фибрилляции предсердий не делают различий между любыми отдельными NOAC и между NOAC и варфарином. В своем консенсусном документе о локальном внедрении рекомендаций NICE по использованию NOAC, NICE создает следующие пункты в отношении выбора антикоагулянтов для отдельных пациентов:
- Пациенты со своим клиницистом должны принимать активное участие во время принятия решения о вариантах лечения антикоагулянтами и соглашаться с наиболее подходящей для них терапией
- Три NOAC, которые в настоящее время лицензированы в Великобритании, должны быть доступны для назначения в соответствии с их лицензированными показаниями и должны автоматически включаться в локальные рецептурные справочники
- Необходимо пересмотреть местные соглашения по использованию антитромботических методов лечения фибрилляции предсердий и разработать политику, направленную на интеграцию NOAC в методы оказания помощи
- Назначение NOAC на первичном звене оказания медицинской помощи требует локальных рекомендаций. Не все врачи общей практики могут быть экспертами в области антикоагулянтной терапии при фибрилляции предсердий. По мере того как эпидемия фибрилляции предсердий продолжает увеличиваться, для достижения лидерства среди препаратов потребуются локальные антикоагулянтные «чемпионы».
На самом деле выбор антикоагулянта обусловлен в основном локальными органами, назначающими препараты, причем стоимость часто является важным фактором. Позиция многих экономически развитых стран заключается в том, что варфарин будет первой линией терапии. NICE предлагает, что введение лечения NOAC может быть полезным, начиная с групп пациентов, которые, скорее всего, получат выгоду, включая пациентов, которые:
- Пациенты, которые не могут принимать антагонисты витамина К
- Не могут стабилизироваться на антагонистах витамина К с неудовлетворительным временем в терапевтическом диапазоне (ВТД) (например, <65%), несмотря на адекватную приверженность
- Принимают аспирин для профилактики инсульта.
Кроме того, NOAC можно назначать пациентам с недавно диагностированной фибрилляцией предсердий, если это предпочтительный вариант после обсуждения альтернатив с пациентом. Важно помнить, что у нас гораздо больше опыта использования варфарина для профилактики инсульта при ФП, и для большинства пациентов это безопасно и эффективно.
Пациенты с поражением функции почек
Также важно отметить, что NOAC частично выводятся почками (почти 80% дабигатрана выводится почками). Пациентам с выраженной почечной недостаточностью может потребоваться снижение дозы и тщательный мониторинг функции почек. Следует искать дополнительную информацию и рекомендации по безопасному назначению антикоагулянтов у пациентов с почечной недостаточностью и вы должны проверить сводные характеристики действующего вещества по поводу конкретных деталей.
АСПИРИН ДЛЯ ПРОФИЛАКТИКИ ИНСУЛЬТА
NICE заявляет, что вы НЕ должны предлагать монотерапию аспирином исключительно для профилактики инсульта пациентам с фибрилляцией предсердий. Использование антикоагулянтов снижает частоту инсульта примерно на 50% в этой популяции по сравнению с аспирином. Аспирин больше не считается рентабельной альтернативой антикоагулянтной терапии варфарином или NOAC, и дальнейшее использование аспирина является препятствием для профилактики инсульта с помощью пероральных антикоагулянтов.
Пациенты с ФП, которые уже принимают аспирин
Важно идентифицировать пациентов с ФП, которые уже принимают аспирин для профилактики инсульта и обсуждать с ними риски и преимущества приема аспирина в сравнении с началом антикоагулянтной терапии или отсутствием приема чего-либо. Это можно было бы сделать проактивно, используя опрос или внепланово через ежегодный осмотр ваших пациентов с ФП.
Конечно, многие пациенты будут принимать аспирин для показаний, отличных от ФП (например, для вторичной профилактики сердечно-сосудистых заболеваний). Если у этих пациентов развивается ФП, антикоагулянтную терапию все еще можно рассматривать, но повышенный риск кровотечения следует тщательно обсуждать и документировать.
ПОВТОРНЫЙ ОСМОТР ПАЦИЕНТОВ С ФП
Все пациенты с ФП (независимо от приема антикоагулянтов) должны регулярно проходить повторный осмотр для оптимизации их лечения. Во время этих обзоров вы должны проверить симптомы и осложнения ФП (например, сердечную недостаточность) и оптимизировать снижение риска инсульта.
Пациенты с ФП, которые не принимают антикоагулянты, должны пройти повторный осмотр, если изменения обстоятельств могут повлиять на риск инсульта или кровотечения в соответствии с CHA2DS2-VASc и HAS-BLED. Они должны быть пройти повторный осмотр, когда они достигнут возраста 65 лет, или если в любом возрасте у них возникнет одно из следующего:
- Сахарный диабет
- Сердечную недостаточность
- Заболевания периферических артерий
- Ишемическая болезнь сердца
- Инсульт, транзиторная ишемическая атака или системный тромбоэмболизм.
Для пациентов, не принимающих антикоагулянты, потому что риск кровотечения был слишком высоким, следует помнить, что некоторые факторы риска кровотечения являются модифицируемыми и могут измениться. Эти пациенты должны проходить повторный осмотр по крайней мере ежегодно, чтобы пересмотреть риски и преимущества антикоагулянтной терапии.
ПОВТОРНЫЙ ОСМОТР ПАЦИЕНТОВ, ПРИНИМАЮЩИХ АНТИКОАГУЛЯНТЫ ПРИ ФП
Антикоагулянтная терапия эффективна только в том случае, если ее принимают регулярно и в соответствии с назначением. Согласие пациентов имеет первостепенное значение для обеспечения оптимальной профилактики инсульта. Все люди, принимающие антикоагулянты при ФП, должны проходить повторный осмотр не реже одного раза в год. Это следует делать чаще, если возникают клинически значимые события, которые влияют на антикоагулянтную терапию или риск кровотечения. В это время необходимо учитывать необходимость антикоагулянтной терапии и качество антикоагуляции.
При приеме варфарина эффективность антикоагуляции легко проверить путем измерения МНО и расчета времени в терапевтическом диапазоне (ВТД) с использованием уравнения Rosendaal. Это лучше всего сделать с помощью компьютеризированного программного обеспечения для поддержки принятия решений. Впрочем, при его отсутствии можно определять терапевтический контроль, используя долю анализов, результаты которых соответствуют терапевтическому диапазону.
ВТД следует рассчитывать на период применения не менее шести месяцев. На низкий контроль антикоагуляции может указывать:
- Два значения МНО >5 или одно значение МНО >8 за последние шесть месяцев
- Два значения МНО <1,5 за последние шесть месяцев
- Значение ВТД <65%.
Если у вашего пациента низкий контроль антикоагуляции, вы должны учитывать следующие факторы:
- Приверженность к терапии
- Когнитивные функции
- Заболевания
- Взаимодействие между препаратами
- Факторы образа жизни, такие как соблюдение диеты и потребление алкоголя.
Любые выявленные факторы могут быть, по возможности, модифицированы для улучшения контроля антикоагулянтной терапии. Если контроль улучшить не удается, вы должны переоценить риски и преимущества антикоагулянтной терапии и рассмотреть альтернативы варфарину: NOAC или отсутствие терапии.
Вы также должны регулярно проводить повторный осмотр пациентов, принимающих NOAC, обычно ежегодно. При применении NOAC невозможно контролировать эффективность антикоагуляции и необходим тщательный расспрос, чтобы установить, регулярно ли пациент принимает препарат. Европейская ассоциация сердечного ритма рекомендует следующее для пациентов, принимающих NOAC.
Проверять при каждом посещении:
- Соблюдение назначений (пациент должен принести оставшиеся препараты)
- Тромбоэмболические события
- Кровотечения
- Другие побочные эффекты
- Одновременный прием препаратов и безрецептурные препараты.
Вы должны также оценить когнитивные функции и факторы образа жизни при каждом осмотре.
Анализы крови:
- Мониторинг уровня антикоагуляции не требуется
- Ежегодно — уровень гемоглобина, функция почек и печени
- Функция почек:
- Раз в шесть месяцев, если клиренс креатинина = 30-50 мл/мин, >75 лет или у ослабленных пациентов
- Раз в три месяца, если клиренс креатинина = 15-30 мл/мин
- Функции почек и печени, если возникает какое-либо состояние, которое может оказать влияние.
С 1 января 2018 г. в Европейском регионе ВОЗ заболели корью более 100 000 человек, умерли – более 90.
ВОЗ намерена расширить комплекс мер в ответ на продолжающиеся вспышки заболевания, в том числе за счет создания оперативного механизма, который позволит ускорить предоставление поддержки странам, затронутым данной проблемой. Такое решение опирается на информацию о росте случаев заболевания корью и смерти от кори среди детей и взрослых, а также о постоянном наличии во многих странах контингентов непривитых или не полностью привитых лиц, что способствует дальнейшему распространению заболевания.
ВОЗ оказывает регулярную поддержку странам с неблагоприятной ситуацией по заболеваемости, направленную на повышение охвата иммунизацией и сдерживание дальнейшего распространения вируса. Однако во многих странах он продолжает циркулировать, и эта ситуация требует более активных действий, говорится в пресс-релизе организации.
«Мы наблюдаем беспрецедентный рост числа больных этим предотвратимым заболеванием и слишком большое число обусловленных им смертей. Это недопустимая ситуация, поэтому нам необходимо действовать более решительно», – отмечает доктор Dorit Nitzan, и.о. руководителя отдела ВОЗ по чрезвычайным ситуациям в области здравоохранения в Европейском регионе.
Более других государств Европы вирусом кори оказалась поражена Украина. Сегодня Минздрав республики сообщил о снятии возрастных ограничений для бесплатной вакцинации.
Лапароскопические вмешательства при паховых грыжах — одно из бурно развивающихся направлений в герниохирургии. Хороший эстетический результат, низкая частота рецидива, небольшое количество осложнений операционной раны, редкое развитие ишемического орхита, отсутствие выраженного послеоперационного болевого синдрома, быстрые выздоровление и реабилитация пациентов, возможность одномоментного выполнения герниопластики с обеих сторон без дополнительных разрезов: лапароскопическая герниопластика практически вытеснила традиционные методы пластики грыж.
Показания и противопоказания
Показания
Показания к проведению лапароскопической герниопластики:
- косые паховые грыжи (чаще среди молодых людей), когда внутреннее паховое кольцо не расширено и грыжевое выпячивание распространяется от внутреннего пахового кольца до средней трети пахового канала;
- косые паховые грыжи при значительно расширенном внутреннем паховом кольце,
- когда грыжевой мешок не спускается в мошонку, но при натуживании грыжевое выпячивание определяется под кожей в паховой области;
- все виды прямых паховых грыж, когда имеются слабость и растяжение поперечной фасции, что приводит к нарушению строения задней стенки пахового канала.
NB! Рецидивные грыжи после открытой герниопластики, билатеральные и бедренные грыжи также являются показанием к эндовидеохирургическим операциям.
Противопоказания
К абсолютным относятся:
- непереносимость напряженного карбоперитонеума;
- беременность, сопутствующие заболевания и состояния, не позволяющие проводить общую анестезию;
- любые признаки локальной и диффузной внутрибрюшной инфекции,
флегмона грыжевого мешка и наличие кишечной непроходимости.
К относительным противопоказаниям относятся ущемленные грыжи, пахово-мошоночные грыжи значительных размеров и перенесенные ранее операции в нижних отделах брюшной полости и малого таза. Раньше к этой категории относилось ожирение III–IV степени, но сейчас, с усовершенствованием инструментария, оно таковым не является.
Общие принципы лапароскопической герниопластики паховых грыж
Прежде чем рассказать об основных лапароскопических техниках и их различиях, остановимся на общих принципах проведения лапароскопических герниопластик при паховых грыжах. Их можно сформулировать следующим образом:
- Выкраивание лоскута брюшины и препарирование предбрюшинного пространства должны иметь размеры, достаточные для свободного расположения имплантата.
- Грыжевой мешок должен быть полностью мобилизован и вывернут либо резецирован для предотвращения заворачивания нижнего края протеза в области шейки мешка после перитонизации.
- Независимо от вида грыж, размер протезной сетки должен быть достаточным для укрытия обеих паховых и бедренных ямок (8×13см).
- При косых паховых грыжах обязателен крой имплантата с подведением его под мобилизованный семенной канатик.
- При наложении скобок необходимо учитывать анатомию пахового канала и места прохождения основных сосудов и нервов.
- Желательна фиксация медиального угла протезной сетки к надкостнице лонного бугорка (при наличии степлеров, способных его прошивать).
- При фиксировании верхнего края протеза рекомендуется использовать прием «противоупора» рукой брюшной стенке, напротив степлера, в этом случае скрепки располагаются перпендикулярно к ней и проникают глубже.
Существуют два основных метода эндоскопической пластики, один из которых производится через брюшную полость (ТАРР), другой выполняется без входа в брюшную полость (ТЕР). Расскажем о каждом из них.
Трансабдоминальная преперитонеальная герниопластика (TAPP)
Суть TAPP — устранение грыжевого дефекта со стороны брюшной полости и укрепление задней стенки пахового канала при помощи сетчатого имплантата.
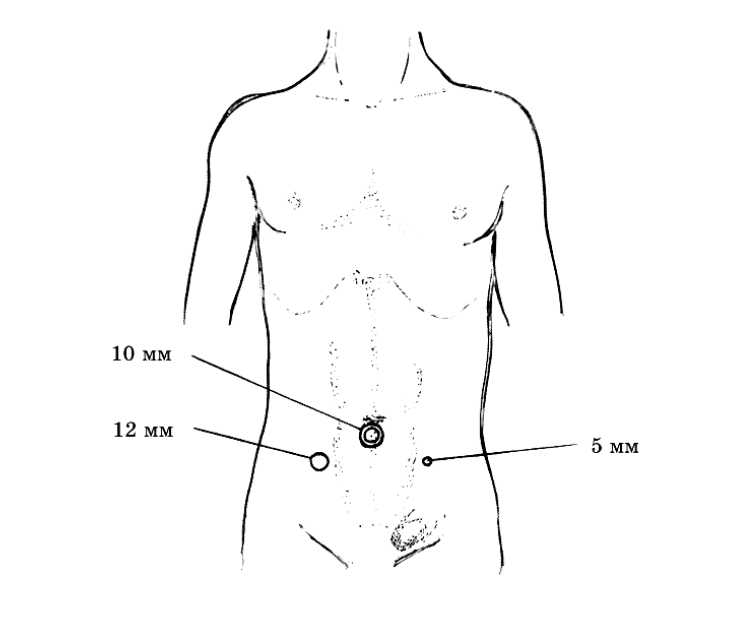
Производится введение троакаров в типичных точках, после чего вводится оптика и осматриваются паховые области с обеих сторон.
Рисунок 1 | точки установки троакаров при TAPP пластике
Возможность интраоперационного выявления паховых грыж с обеих сторон является преимуществом данного метода. К тому же, «попутно» можно осмотреть органы брюшной полости, что также можно отнести к плюсам TAPP.
Во время визуального осмотра выявляется грыжевой мешок и определяется, какая именно грыжа у пациента: косая или прямая. Грыжевой мешок при косой паховой грыже легко определяется как углубление брюшины латерально от нижних эпигастральных сосудов. При прямой грыже визуальное определение грыжевого мешка может быть затруднено ввиду его большой ширины и возможного наличия жира в предбрюшинной клетчатке.
После визуализации грыжи начинается препаровка. Выделяется надкостница лонной кости — Куперова связка, фасция прямой мышцы, подвздошно-лонный тракт, а также фасциальные структуры поперечной мышцы живота. К этим структурам впоследствии будет фиксироваться сетчатый имплантат.
После препарировании моделируется сам имплантат — его размер должен быть рассчитан таким образом, чтобы он мог закрыть, помимо грыжевого дефекта, паховые ямки и сосудистую лакуну. Также сетка не должна быть слишком большой, иначе она будет сворачиваться и образовывать складки, из-за чего ее каркасная функция будет нарушена.
Правильно расположив сетку в паховой области, приступают к ее фиксации. Сетчатый имплантат закрепляют к подготовленной площадке при помощи одно- или многозарядного герниостеплера.
Тотальная экстраперитонеальная герниопластика (TEP)
TEP — более дорогостоящая операция по расходному материалу и более сложная в исполнении. Наибольшее распространение она получила в США.
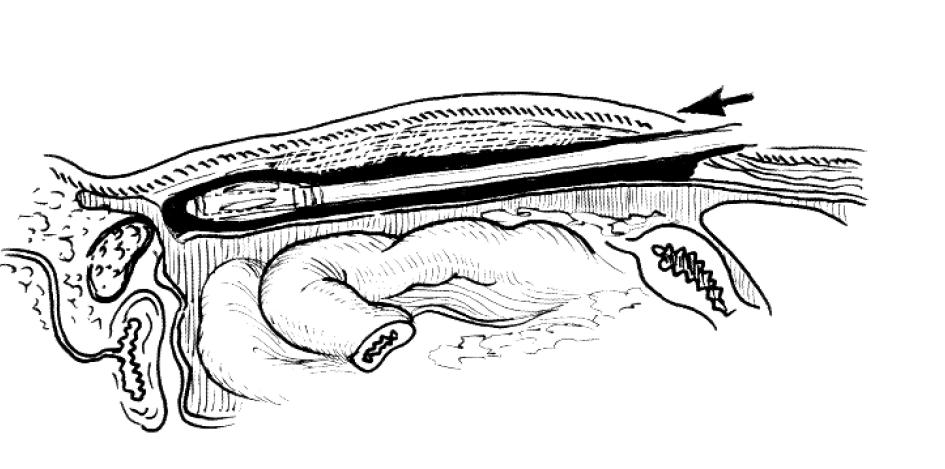
Суть тотальной экстраперитонеальной герниопластики состоит в том, что для манипуляций создается пространство вне брюшной полости. Для этого заводится специальный инструмент — балонный диссектор, на конце которого есть специальная манжета. При ее раздувании создается достаточное поле в предбрюшинном пространстве.
Рисунок 2 | Балонный диссектор в предбрюшинном пространстве
После расширения предбрюшинного клетчаточного пространства в него заводится оптика, производится препаровка: выделяются элементы семенного канатика и поперечная фасция. Затем заводится сетчатый имплантат в предбрюшинное пространство, которое «схлопывается» сразу же после изъятия инструментов и троакаров.
Из-за того, что работа происходит в пространстве, которое в норме не обладает такими объемами, манипуляции стоит проводить с осторожностью. В противном случае, есть вероятность пробиться в брюшную полость, что нежелательно при TEP. К тому же, сама тотальная экстроперитонеальная герниопластика требует большого мастерства и опыта, поэтому техника пока еще не до конца прижилась в условиях России её владеют относительно малое количество специалистов.
Традиционные техники больше не нужны?
Наличие малоинвазивных лапароскопических техник вовсе не означает полный отказ от традиционных хирургических подходов в герниологии. Порой операция с открытым доступом может быть более предпочтительна (см. противопоказания к лапароскопической герниопластике), да и технически такие операции на порядок выше.
Но за TAPP, TEP и другими лапароскопическими методами лечения стоит, если не настоящее, то однозначно будущее.
Всемирная организация здравоохранения выпустила новое руководство по снижению риска развития деменции. По оценкам экспертов, в ближайшие 30 лет число страдающих слабоумием в мире вырастет втрое.
«По прогнозам, через 30 лет число людей с деменцией утроится, — заявил Генеральный директор ВОЗ д-р Тедрос Адханом Гебрейесус. — Мы должны делать все возможное для снижения риска развития деменции. Научные данные, собранные для настоящего руководства, подтвердили высказанное нами некоторое время назад предположение, — то, что хорошо для нашего сердца, хорошо и для нашего мозга».
По данным нового руководства ВОЗ, риск развития деменции можно снизить, если соблюдать правила, которые принято называть здоровым образом жизни. Среди рекомендаций ВОЗ, отмеченных в докладе как «настоятельные» для снижения угасания когнитивных функций, перечислены физическая активность (для пациентов с нормальным состоянием когнитивных функций) и отказ от курения. Далее идут такие советы, как снижение или полный отказ от употребления алкоголя, когнитивный тренинг, профилактика избыточного веса в среднем возрасте, контроль за артериальным давлением, уровнем холестерина и сахара в крови. Также эксперты рекомендуют участвовать в социально-культурных мероприятиях, хоть и отмечают, что данных о взаимосвязи активной социальной жизни и снижением риска развития деменции пока недостаточно. Между тем, по их мнению, «социальную вовлеченность следует поддерживать в течение всей жизни» — она тесно связана со здоровьем и благополучием в любом возрасте. В своем докладе специалисты также упомянули депрессию и потерю слуха в старости, но при этом вновь уточнили, что доказательств взаимосвязи между приемом антидепрессантов и применением слуховых аппаратов с одной стороны и - риском развития деменции с другой на сегодня недостаточно.Предполагается, что это руководство будет полезным не только медикам для консультаций и профилактики заболеваний среди своих пациентов, но также для властей и тех, кто занимается организацией программ по здоровому образу жизни.Деменция - прогрессирующая и неизлечимая болезнь, при которой у человека происходит быстрее, чем при нормальном старении ухудшение памяти, мышления, ориентации, способности считать, разговаривать, понимать и рассуждать. В частности, деменция развивается в результате ряда заболеваний и травм мозга, например, при болезни Альцгеймера, после инсульта и становится одной из основных причин инвалидности и несамостоятельности пожилых людей. Сегодня в мире проблемы, связанные с деменцией, затрагивают около 50 млн человек. По данным ВОЗ, каждый год регистрируется около 10 млн новых случаев деменции.
Шизофрения — психическое заболевание, для которого характерна дисгармоничность и утрата единства психических функций. Как правило, при сохранении ясного сознания и интеллектуальных способностей наблюдаются расстройства мышления и восприятия, а также неадекватный или сниженный аффект. При этом с течением времени могут проявиться когнитивные нарушения, способствующие разрушению субъективного переживания целостности личности больного, ее автономности. Течение шизофрении может быть непрерывным или приступообразным с разной выраженностью продуктивной и негативной симптоматики. Долгое время в психиатрии царило убеждение, что шизофрения с течением времени неизбежно приводит к изменениям личности в виде аутизма, снижения энергетического потенциала, эмоционального уплощения и патологической инвертированности. Однако в настоящее время многочисленные катамнестические исследования указывают на то, что около 20–25 % больных шизофренией выздоравливают. Напротив, частые психотические приступы с последующей госпитализацией наблюдаются только у 9 % больных. Таким образом, у значительной доли больных обнаруживается благоприятное течение заболевания, и большую часть времени они находятся в состоянии ремиссии.
Распространенность шизофрении составляет порядка 0,28 % от общей популяции, в общей сложности в мире насчитывается более 20 миллионов больных, при этом наблюдается тенденция к росту числа зафиксированных случаев.
Еще Эмиль Крепелин, с именем которого связывается выделение шизофрении в самостоятельную нозологическую форму, указывал на существование нескольких вариантов протекания болезни, которые были представлены кататонической, гебефренической и простой формой шизофрении. Простая шизофрения возникала в юношеском возрасте и характеризовалась прогрессирующим оскудением эмоций, интеллектуальной непродуктивностью, утратой интересов, нарастающей вялостью. Крепелин указывал, что для данной формы болезни характерна слабая выраженность позитивной симптоматики (галлюцинаторной и бредовой продукции). Гебефреническая форма отличалась дурашливостью, нескоординированностью мышления и речи, кататоническими и бредовыми расстройствами. Для вышеобозначенных форм заболевания Крепелин отмечал неблагоприятное течение, хотя для гебефренической формы не исключалась возможность ремиссии. При кататонической форме отмечалось преобладание кататонического синдрома, выражающегося как кататоническим ступором, так и возбужденным состоянием, сопровождающимся негативизмом, бредом и галлюцинаторной продукцией. Выделенная в дальнейшем параноидная форма шизофрении характеризовалась доминированием бредовых идей, которые сопровождались галлюцинациями или псевдогаллюцинациями.
Классификация Крепелина, однако, имела один серьезный недостаток, связанный с тем, что в основе ее построения лежал тот или иной психопатологический синдром, преобладающий в клинической картине. Более поздние исследования показали неоднородность клинической картины выявленных форм болезни.
В настоящее время в МКБ-10 выделяется 10 типов шизофрении, один из которых представлен постшизофренической депрессией, нозологический статус которой не до конца ясен.
Параноидная шизофрения — наиболее часто встречающаяся форма. Продуктивная симптоматика представлена относительно стабильным, часто параноидным, бредом, который может сопровождаться галлюцинациями, расстройствами восприятия. Негативная симптоматика, по крайней мере, на ранних стадиях болезни, выражена слабо.
Наиболее часто встречаются:
1) бред преследования, отношения и значения, особого предназначения, изменений тела, ревности или высокого происхождения;
2) голоса, озвучивающие содержание императивного или угрожающего характера, слуховые галлюцинации невербального характера: свист, шорох и т. д.;
3) вкусовые галлюцинации, тактильные и/или обонятельные. Характерна эмоциональная неадекватность, резкие перемены настроения, приступы гнева или страха.
Гебефреническая шизофрения характеризуется резонерством, манерностью и непредсказуемостью поведения, зачастую дурашливостью, фрагментарностью бреда. Аффект неадекватный, выражается в беспричинном смехе, проказах, повторяющихся словесных выражениях. Для данной формы шизофрении характерна разорванность речи и мышления, выражена негативная симптоматика, что является причиной плохого прогноза этого типа заболевания. Большие трудности доставляет нарушение целенаправленности поведения и возможностей его контроля. Манифестация обычно в юношеском возрасте.
Особенности кататонической шизофрении заключаются в наличии психомоторных расстройств — от гиперкинезов до ступора. Оцепенение может продолжаться в течение долгого времени, иногда, напротив, наблюдается восковая гибкость. Также одной из характерных черт данной формы являются периодически возникающие эпизоды агрессии. При диагностировании данной формы шизофрении важно исключить органическое и экзогенное происхождение психомоторных расстройств.
Недифференцированную шизофрению диагностируют в том случае, когда клиническая картина не может быть отнесена ни к одной из вышеперечисленных групп либо обнаруживает признаки нескольких форм заболевания при отсутствии отчетливо выраженного ведущего синдрома.
Простой тип шизофрении встречается достаточно редко и характеризуется постепенно нарастающей негативной симптоматикой, обусловливающей снижение возможностей социальной адаптации и адекватного реагирования. Продуктивная симптоматика не наблюдается. Простой тип шизофрении имеет один из самых неблагоприятных прогнозов, т. к. в современной психофармакологии не разработано действенных препаратов для купирования нарастающей негативной симптоматики при шизофрении.
Выделение постшизофренической депрессии как отдельной нозологической единицы является весьма дискуссионным вопросом. В настоящий момент не установлено, можно ли включить симптомы депрессии в клиническую картину шизофрении, или же они являются ничем иным, как реакцией на болезнь. Зачастую практически невозможно определить, являются ли наблюдаемые симптомы следствием депрессии, нейролептической терапии или же аффективного уплощения, характерного для длительного течения шизофрении. Однако диагностика данного расстройства имеет большое значение для определения суицидальных рисков пациента.
Резидуальная шизофрения представляет собой хроническую форму шизофрении, при которой имевшие место в прошлом продуктивные симптомы в настоящее время не наблюдаются, при этом негативная симптоматика, характерная для более поздних стадий (замедление психомоторных реакций, притупление аффекта, пассивность, бедность речи и т. д.), еще не проявилась отчетливо.
К другим типам шизофрении относятся ипохондрическая шизофрения, сенестопатическая, детский тип шизофрении, шизофреноформный психоз без других указаний, шизофреноформные расстройства без других указаний.